
Астат.
Этот
химический элемент семейства галогенов имеет символ At и атомный номер
85, он существует только в следовых количествах в некоторых минералах.
Еще в 1869 Д.И.Менделеев предсказал его существование и возможность открытия
в будущем. Астат был открыт Д.Корсоном, К.Маккензи и Э.Сегре в 1940. Известно
более 20 изотопов, из которых наиболее долгоживущие 210At
и 211At.
По некоторым данным, при бомбардировке 20983Bi
ядрами гелия образуется изотоп астат-211; сообщалось, что астат растворим
в ковалентных растворителях, может образовывать At–,
как и другие галогены, и, вероятно, возможно получение иона AtO4–.
(Эти данные удалось получить на растворах с концентрацией 10–10
моль/л.)
ПЕРЕХОДНЫЕ ЭЛЕМЕНТЫ
В
соответствии с периодической классификацией элементов существует 44 элемента,
образующих подгруппы А. В каждой из этих подгрупп (или семейств) на внешней
(валентной) электронной оболочке число электронов равно номеру группы.
При переходе от элемента одной подгруппы к элементу соседней подгруппы
вдоль периода слева направо число валентных электронов возрастает на 1.
Поэтому происходит регулярное изменение свойств от металлических в семействах
с низкими номерами до неметаллических в семействах с б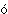 льшими
номерами. В то же время имеется более 60 элементов, которые не подчиняются
вышеописанным принципам застройки электронной структуры. Все эти элементы
являются металлами по своим химическим свойствам (некоторые – очень
активными), сходными с металлами подгруппы IIA. В этом классе находятся
металлы, образующие сплавы (Fe, Mn, Mo, Cu, Zn, Pt, Au и др.) либо являющиеся
драгоценными металлами, обладающие важными структурными свойствами. У
этих элементов в отличие от элементов подгрупп А, у которых заполняется
электронами внешний слой, электроны поступают на внутренние слои, а элементы
называются «переходными». льшими
номерами. В то же время имеется более 60 элементов, которые не подчиняются
вышеописанным принципам застройки электронной структуры. Все эти элементы
являются металлами по своим химическим свойствам (некоторые – очень
активными), сходными с металлами подгруппы IIA. В этом классе находятся
металлы, образующие сплавы (Fe, Mn, Mo, Cu, Zn, Pt, Au и др.) либо являющиеся
драгоценными металлами, обладающие важными структурными свойствами. У
этих элементов в отличие от элементов подгрупп А, у которых заполняется
электронами внешний слой, электроны поступают на внутренние слои, а элементы
называются «переходными».
За некоторыми исключениями, в целом
для электронного строения переходных элементов характерно наличие двух
электронов на внешней электронной оболочке, т.е. на ns-уровне,
и размещение следующих электронов на внутреннюю оболочку, т.е. на уровень
(n –
1) или (n
– 2). Так как химические и многие физические свойства определяются
типом и энергией внешних электронов по отношению к ядру, а структуры внешних
электронных оболочек идентичны для всех переходных элементов, то и наблюдается
много сходства в их химических и физических свойствах. Добавление к каждому
последующему (в ряду периодической таблицы) металлу одного протона к ядру
и одного электрона на внутреннюю оболочку не увеличивает радиуса, а скорее
несколько уменьшает его. Это уменьшение, или сжатие, несопоставимо по
величине с сжатием в горизонтальном ряду непереходных элементов периодической
таблицы (например, от Li до F), но имеет ту же природу.
Переходные элементы можно разделить
на две отдельные группы серий в зависимости от того, расположены последующие
электроны на первом (n
– 1)
или втором (n
– 2)
уровне от внешнего слоя. Соответственно элементы относятся в первом случае
к коротким (1-му и 2-му) переходным рядам и нормальным сериям (d-сериям)
длинных (3-го и 4-го) переходных рядов, а во втором случае – к внутренним
сериям (f-сериям)
длинных переходных рядов (см.
табл. 9).
|
Таблица 9. ПЕРЕХОДНЫЕ
ЭЛЕМЕНТЫ
|
| Ряды
и серии переходных элементов |
Энергетический
уровень
|
Элементы
|
Орбиталь
|
| 1-й ряд
(короткий) |
n – 1
|
21Sc – 30Zn
|
3d
|
| 2-й ряд
(короткий) |
n – 1
|
39Y – 48Cd
|
4d
|
| 3-й ряд
(длинный) |
|
|
|
| внутренняя
серия |
n – 2
|
57La – 71Lu (лантаноиды)
|
4f
|
| нормальная
серия |
n – 1
|
72Hf – 80Hg
|
5d
|
| 4-й ряд
(длинный) |
|
|
|
| внутренняя
серия |
n – 2
|
89Ac – 103Lr (актиноиды)
|
5f
|
Не
всегда можно точно предсказать или рассчитать электронную конфигурацию
элементов с большими атомными номерами, поэтому некоторые обозначения
нельзя считать окончательными. Среди химиков нет полного согласия об обозначении
элементов подгрупп IB и IIB как подгрупп переходных элементов. В частности
это относится к металлам Cu, Ag, Au (IB) и Zn, Cd, Hg (IIB). В каждой
из этих подгрупп элементы содержат внутреннюю завершенную оболочку из
18 электронов. Поэтому если определение переходного элемента предусматривает
расположение очередного электрона во внутренней оболочке, то металлы подгрупп
IB и IIB не являются ни переходными, ни непереходными элементами. Но поскольку
они обладают многими свойствами, общими со свойствами переходных элементов,
то их в этом разделе относят к переходным элементам.
назад
дальше
|


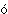 льшими
номерами. В то же время имеется более 60 элементов, которые не подчиняются
вышеописанным принципам застройки электронной структуры. Все эти элементы
являются металлами по своим химическим свойствам (некоторые – очень
активными), сходными с металлами подгруппы IIA. В этом классе находятся
металлы, образующие сплавы (Fe, Mn, Mo, Cu, Zn, Pt, Au и др.) либо являющиеся
драгоценными металлами, обладающие важными структурными свойствами. У
этих элементов в отличие от элементов подгрупп А, у которых заполняется
электронами внешний слой, электроны поступают на внутренние слои, а элементы
называются «переходными».
льшими
номерами. В то же время имеется более 60 элементов, которые не подчиняются
вышеописанным принципам застройки электронной структуры. Все эти элементы
являются металлами по своим химическим свойствам (некоторые – очень
активными), сходными с металлами подгруппы IIA. В этом классе находятся
металлы, образующие сплавы (Fe, Mn, Mo, Cu, Zn, Pt, Au и др.) либо являющиеся
драгоценными металлами, обладающие важными структурными свойствами. У
этих элементов в отличие от элементов подгрупп А, у которых заполняется
электронами внешний слой, электроны поступают на внутренние слои, а элементы
называются «переходными».