|
ЭЛЕМЕНТЫ ХИМИЧЕСКИЕ,
простейшая форма материи, которая может быть идентифицирована химическими методами. Это составные части простых и сложных веществ, представляющие собой совокупность атомов с одинаковым зарядом ядра. Заряд ядра атома определяется числом протонов в нем. Это число является фундаментальным свойством элемента и называется атомным номером, так как совпадает с порядковым номером элемента в периодической системе элементов, открытой в 1869 русским химиком Д.И.Менделеевым. Например, все атомы, содержащие 2 протона в ядре (все атомы с атомным номером 2) являются атомами гелия, они составляют элемент гелий. Все атомы, содержащие 92 протона в ядре, являются атомами урана и составляют элемент уран. Каждый элемент обозначается символом из одной или двух латинских букв названия элемента (например, He – для гелия, U – для урана) или его атомным номером. (Алфавитный список элементов дан в статье ХИМИЯ.)
Кроме протонов атомное ядро обычно содержит нейтроны. Для данного элемента число протонов неизменно, а число нейтронов может меняться. Атомы элемента с различным количеством нейтронов называются изотопами данного элемента. Атом содержит столько же электронов, сколько и протонов, электронные орбитали вокруг ядра располагаются на квантовых уровнях, или слоях. Химические свойства элемента в значительной степени определяются числом электронов на внешнем электронном слое (внешней оболочке), а поскольку все атомы элемента имеют одно и то же число электронов на внешнем слое, то все они имеют одинаковые химические свойства. Физические свойства могут изменяться от изотопа к изотопу. Когда элементы расположены в порядке возрастания атомного номера, элементы со сходными свойствами периодически повторяются. Эта периодичность в свойствах становится весьма очевидной, когда элементы располагают как показано в периодической таблице (рис. 1), где элементы со сходными свойствами расположены в вертикальных колонках, называемых группами (подгруппами) или семействами (см. также ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ).

Из известных химических элементов в природе существуют элементы с атомным номером от 1 до 92; исключение составляют технеций (ат. номер 43) и прометий (ат. номер 61), которые получены искусственно путем ядерных реакций. Все трансурановые элементы с атомными номерами от 93 также получены искусственно. В космосе наиболее распространены водород и гелий. На Земле два десятка элементов составляют в основном массу земной коры: O (46,6%), Si (27,7%), Al (8,1%), Fe (5,0%), Ca(3,6%), Na (2,8%), K (2,6%), Mg (2,1%), Ti (0,5%), P (0,2%), H (0,14%), Mn (0,1%), S (0,05%), F (0,05%), Cl (0,03%), Sr (0,03%), C (0,03), Ba (0,02%), Cr (0,02%), а на все остальные элементы приходится чуть больше 0,3% (масс.).
Химические элементы существуют в виде простых веществ, состоящих из атомов одного элемента, и в виде химических соединений, состоящих из атомов разных элементов. Например, вода – это соединение водорода и кислорода. Свойства соединения отличаются от свойств образовавших его элементов; так, водород и кислород имеют четко выраженные отличные от свойств воды свойства. В химических реакциях атомы стремятся к взаимодействию, чтобы перейти в более устойчивое состояние, удерживая на внешних электронных оболочках максимально возможное число электронов; происходит это в результате перемещения или спаривания электронов. (Химические реакции, строение атома, строение электронных оболочек наиболее полно изложены в статье ХИМИЯ.)
ГРУППА 0. БЛАГОРОДНЫЕ (ИНЕРТНЫЕ) ГАЗЫ
ГЕЛИЙ, НЕОН, АРГОН, КРИПТОН, КСЕНОН, РАДОН
Атомы элементов нулевой группы имеют полностью завершенную внешнюю электронную оболочку, что соответствует наиболее стабильной электронной конфигурации, и в течение многих лет считалось, что эти элементы не образуют химических соединений. Поэтому рассматриваемое семейство называли «инертные газы». Однако в 1962 в Университете Британской Колумбии (Канада) был синтезирован гексафтороплатинат ксенона Xe2PtF6. Позже были синтезированы другие соединения ксенона, а также криптона и радона.
Молекулы благородных газов одноатомны
в отличие от большинства распространенных газов, содержащихся в атмосфере
(азот, кислород), и водорода, молекулы которых двухатомны. Благородные
газы имеют очень низкие температуры сжижения и затвердевания (табл. 1)
при нормальном давлении. Например, для гелия, самого легкого элемента,
эти температуры находятся вблизи абсолютного нуля (0 K
= –273,16°
C). Также очень малы температурные области существования этих газов в
жидком состоянии (разность температур кипения и плавления) и значения
энергий перехода твердое состояние  жидкость жидкость газ. Эти д анные свидетельствуют об очень слабом межмолекулярном взаимодействии
(вандерваальсовы силы очень малы), поэтому благородные газы максимально
близки к состоянию идеальных газов и для них наиболее строго соблюдаются
фундаментальные газовые законы (закон Бойля и др.). В случае сильной ионизации
(например, в сильном магнитном поле или искровом разряде в неоновых трубках)
электроны атомов этих газов могут вылетать, образуя заряженные частицы
(см. энергию
ионизации в табл. 1). В этих условиях затраты энергии велики.
газ. Эти д анные свидетельствуют об очень слабом межмолекулярном взаимодействии
(вандерваальсовы силы очень малы), поэтому благородные газы максимально
близки к состоянию идеальных газов и для них наиболее строго соблюдаются
фундаментальные газовые законы (закон Бойля и др.). В случае сильной ионизации
(например, в сильном магнитном поле или искровом разряде в неоновых трубках)
электроны атомов этих газов могут вылетать, образуя заряженные частицы
(см. энергию
ионизации в табл. 1). В этих условиях затраты энергии велики.
Таблица
1. БЛАГОРОДНЫЕ ГАЗЫ
Гелий.
Гелий был открыт в 1868 при изучении
солнечного затмения. При спектроскопическом анализе солнечной хроносферы
была обнаружена желтая спектральная линия, первоначально отнесенная к
спектру натрия, однако в 1871 Н.Локьер и Ж.Жансен доказали, что эта линия
не относится ни к одному из известных на земле элементов. Э.Франкленд
назвал новый элемент гелием от греческого слова «гелиос», означающего
«солнце». В 1895 У.Рамзай выделил и идентифицировал гелий из минерала
клевеита и доказал, что спектральные линии газа, выделяющегося из этого
минерала, идентифицируются с линиями, наблюдаемыми при спектральном исследовании
хромосферы солнца. Гелий получают в настоящее время в больших количествах
из некоторых скважин природного газа в США. Особенно богатые выходы (до
8% гелия) находятся вблизи Декстера (шт. Канзас). Выделение гелия из природных
газов нефтяных месторождений возможно методом фракционного охлаждения.
Гелий
обладает рядом необычных физических свойств. Например, при свободном расширении
гелий нагревается вместо охлаждения, характерного для большинства газов.
При Ј 40
K
(–233,15°
C) термический эффект расширения становится нормальным. При 3 K
(–270,15°
C) образуется необычная форма жидкого гелия – гелий II, обладающий
сверхтекучестью – свойством подниматься по стенкам сосуда и перетекать,
а также необычно высокой проводимостью и малой вязкостью.
Применение.
Гелий находит многочисленные применения. Поскольку он значительно легче
воздуха, то используется в воздухоплавательных аппаратах. Самый легкий газ
– это водород (мол. масса 2,016), который легче гелия, но способен
взрываться в смеси с воздухом, тогда как гелий инертен и поэтому предпочтительнее
для наполнения воздушных шаров. Шар, заполненный гелием, должен быть в объеме
всего на 8% больше, чем водородный шар, чтобы поднять такой же груз.
Гелий, как и другие инертные газы, применяют
для создания инертной среды в химических процессах (например, для предотвращения
реакций с воздухом или кислородом). Сварка магния, алюминия и титана,
а также специальных стальных сплавов проводится в гелиевой среде. В кислородную
смесь для водолазов часто добавляют гелий вместо азота, т.к. такая смесь
исключает проблемы, связанные с декомпрессионной болезнью (растворимость
гелия в крови меньше, чем азота, что уменьшает время декомпрессии и соответственно
болезненные ощущения). Жидкий гелий обеспечивает возможность охлаждать
вещества до температур, близких к абсолютному нулю; при таких температурах
часто обнаруживаются необычные свойства вещества.
Реакции
образования. Наиболее
общей формой гелия является изотоп 42He,
называемый гелий-4. (Нижняя цифра перед символом элемента обозначает атомный
номер, т.е. заряд ядра, а верхняя цифра – массовое число изотопа,
или общее число протонов и нейтронов, в данном случае 2 протона и 2 нейтрона.)
Гелий 42He
получается из a-частицы,
состоящей из 2 протонов и 2 нейтронов, при присоединении 2 электронов,
а a-частица
является продуктом распада радиоактивного материала. Другой изотоп гелия
32He
(2 протона и 1 нейтрон) стабилен, но его содержание составляет всего 14
атомов на 10 000 атомов гелия-4. Он образуется в результате космических
превращений, например при бомбардировке дейтерия 21H
космическими лучами получается
нестабильный тритий 31H,
который, испуская b-частицу,
образует 32He.
См.
также ГЕЛИЙ.
Неон
впервые был выделен У.Рамзаем
и М.Траверсом в 1898 при фракционном разделении воздуха. Из 44 т жидкого
воздуха можно получить всего около 450 г неона. В газоразрядной трубке
возбужденный неон имеет приятный красно-оранжевый или розовый цвет. Существенные
количества неона используются в неоновой рекламе. При смешении неона с
парами ртути можно получать различную окраску.
Аргон
был открыт как инертный
газ в атмосфере в 1894 Дж.Рэлеем, который обнаружил, что атмосферный азот
на 0,5% тяжелее, чем полученный химическим путем. Разница объяснялась
присутствием ничтожного количества более тяжелых инертных газов, преимущественно
аргона. Этот элемент был первым из инертных газов, обнаруженных в природе
на нашей планете. Содержание аргона в атмосфере составляет 0,93%(об.),
причем его несколько больше над поверхностью больших водоемов, чем над
сушей, так как азот и кислород более растворимы в воде. В электротехнической
промышленности ежемесячно расходуется несколько тысяч кубических метров
аргона для создания инертной среды в лампах накаливания: аргоновая среда
позволяет снизить скорость испарения вольфрамовой нити и предотвращает
ее окисление.
Криптон
был открыт У.Рамзаем
и М.Траверсом в 1898 при анализе остатков воздуха после разделения. Необычное
свойство газа заключается в возможности создания при его возбуждении интенсивной
вспышки, длящейся только 0,00002 с. Поэтому его используют для высокоскоростной
фотографии.
Ксенон
и радон. Ксенон,
тяжелый благородный газ со стабильным ядром, был открыт У.Рамзаем и М.Траверсом
в 1898. Радон, самый тяжелый из благородных газов, был открыт в 1900 Э.Резерфордом
(220Rn)
и Ф.Дорном и А.Дебьёрном (222Rn),
а в 1903 Ф.Гизель и Дебьёрн открыли 219Rn.
Атом радона имеет три короткоживущих изотопа 222, 220 и 219 и отличается
чрезвычайно нестабильной структурой ядра; он испускает a-частицы,
образуя полоний. Радий распадается до радона, и поэтому все минералы,
содержащие радий, содержат радон. Для выделения радона из таких минералов
требуется сильное нагревание. Радон из радия собирают в ловушки и размещают
в золотых ампулах для лечения больных раком. g-Излучение
радона идентично излучению радия, и раковые больные получают лечение с
помощью ампулы, вшитой в участок тела вблизи злокачественной опухоли.
ВОДОРОД
Водород
– наиболее распространенный элемент во Вселенной. Он соcтавляет
б льшую
часть вещества звезд и межзвездной материи. С кислородом он образует наиболее
распространенное на земле вещество – воду, а совместно с углеродом
входит в состав каждого органического соединения. Водород – самый
легкий элемент с атомным номером 1; ядро протия – наиболее стабильного
изотопа водорода – состоит только из одного протона без нейтронов.
Всего у водорода три изотопа: 1) наиболее распространенный – протий
11H,
2) дейтерий – 21H
(или 21D)
часто называют «тяжелый» водород, 3) наименее распространенный изотоп
– тритий 31H
(или 31T)
является радиоактивным и поэтому в природе не встречается в сколько-нибудь
значительном количестве. Водород – бесцветный газ, без запаха, легко
возгорается при комнатной температуре, плохо растворяется в воде. Он находит
широкое применение в промышленности, например при гидрогенизации жиров
и масел. льшую
часть вещества звезд и межзвездной материи. С кислородом он образует наиболее
распространенное на земле вещество – воду, а совместно с углеродом
входит в состав каждого органического соединения. Водород – самый
легкий элемент с атомным номером 1; ядро протия – наиболее стабильного
изотопа водорода – состоит только из одного протона без нейтронов.
Всего у водорода три изотопа: 1) наиболее распространенный – протий
11H,
2) дейтерий – 21H
(или 21D)
часто называют «тяжелый» водород, 3) наименее распространенный изотоп
– тритий 31H
(или 31T)
является радиоактивным и поэтому в природе не встречается в сколько-нибудь
значительном количестве. Водород – бесцветный газ, без запаха, легко
возгорается при комнатной температуре, плохо растворяется в воде. Он находит
широкое применение в промышленности, например при гидрогенизации жиров
и масел.
Водород занимает особое положение в
периодической системе (см.
рис. 1), так как его электронная структура состоит всего из одного электрона.
Способность отдавать его, образуя ионную связь, роднит водород со щелочными
металлами, и его располагают в верху подгруппы щелочных металлов (подгруппа
IА).
Но водород может и принимать один электрон, проявляя отрицательную степень
окисления, как галогены (фтор, хлор и др.), поэтому его иногда называют
«псевдогалоген» и размещают в верху подгруппы галогенов (подгруппа VIIA).
См. также
ВОДОРОД.
ПОДГРУППА IА.
ЩЕЛОЧНЫЕ МЕТАЛЛЫ
ЛИТИЙ, НАТРИЙ, КАЛИЙ, РУБИДИЙ, ЦЕЗИЙ,
ФРАНЦИЙ
Электронное строение щелочных металлов
характеризуется наличием на внешней электронной оболочке одного электрона,
относительно слабо связанного с ядром. С каждого щелочного металла начинается
новый период в периодической таблице. Щелочной металл способен отдавать
свой внешний электрон легче, чем любой другой элемент этого периода. Разрез
щелочного металла в инертной среде имеет яркий серебристый блеск. Щелочные
металлы отличаются невысокой плотностью, хорошей электропроводностью и
плавятся при сравнительно низких температурах (табл. 2).
Таблица
2. ЩЕЛОЧНЫЕ МЕТАЛЛЫ
Благодаря высокой активности щелочные
металлы в чистом виде не существуют, а встречаются в природе только в
виде соединений (исключая франций), например с кислородом (глины и силикаты)
или с галогенами (хлорид натрия). Хлориды являются сырьем для получения
щелочных металлов в свободном состоянии. Морская вода содержит ~3%
NaCl и следовые количества других солей. Очевидно, что озера и внутренние
моря, а также подземные отложения солей и рассолы содержат галогениды
щелочных металлов в б льших
концентрациях, чем морская вода. Например, содержание солей в водах Большого
Соленого озера (шт. Юта, США) составляет 13,8–27,7%, а в Мертвом
море (Израиль) – до 31% в зависимости от площади зеркала воды, изменяющейся
от времени года. Можно полагать, что незначительное содержание KCl в морской
воде по сравнению с NaCl объясняется усвоением иона K+
морскими растениями. льших
концентрациях, чем морская вода. Например, содержание солей в водах Большого
Соленого озера (шт. Юта, США) составляет 13,8–27,7%, а в Мертвом
море (Израиль) – до 31% в зависимости от площади зеркала воды, изменяющейся
от времени года. Можно полагать, что незначительное содержание KCl в морской
воде по сравнению с NaCl объясняется усвоением иона K+
морскими растениями.
В свободном виде щелочные металлы получают
электролизом расплавов таких солей, как NaCl, CaCl2,
CaF2
или гидроксидов (NaOH), так как нет более активного металла, способного
вытеснить щелочной металл из галогенида. При электролизе галогенидов необходимо
изолировать выделяющийся на катоде металл, так как одновременно на аноде
выделяется газообразный галоген, активно реагирующий с выделяющимся металлом.
См. также ЩЕЛОЧЕЙ
ПРОИЗВОДСТВО.
Поскольку у щелочных металлов на внешнем
слое всего один электрон, каждый из них является наиболее активным в своем
периоде, так, Li – самый активный металл в первом периоде из восьми
элементов, Na – соответственно во втором, а K – самый активный
металл третьего периода, содержащего 18 элементов (первый переходный период).
В подгруппе щелочных металлов (IA) способность отдавать электрон возрастает
сверху вниз.
Химические
свойства. Все
щелочные металлы активно реагируют с кислородом, образуя оксиды или пероксиды,
отличаясь в этом друг от друга: Li
превращается в Li2O,
а другие щелочные металлы – в смесь M2O2
и MO2,
причем Rb и
Cs
при этом возгораются. Все щелочные металлы образуют с водородом солеподобные
термически стабильные при высоких температурах гидриды состава M+H–,
являющиеся активными восстановителями; гидриды разлагаются водой с образованием
щелочей и водорода и выделением теплоты, вызывающей воспламенение газа,
причем скорость этой реакции у лития выше, чем у Na и K.
См. также
ВОДОРОД;
КИСЛОРОД.
В жидком аммиаке щелочные металлы растворяются,
образуя голубые растворы, и (в отличие от реакции с водой) могут быть
выделены снова при испарении аммиака или добавлении соответствующей соли
(например, NaCl
из его аммиачного раствора). При реакции с газообразным аммиаком реакция
протекает подобно реакции с водой:

Амиды
щелочных металлов проявляют основные свойства подобно гидроксидам.
Большинство
соединений щелочных металлов, кроме некоторых соединений лития, хорошо
растворимы в воде. По атомным размерам и зарядовой плотности литий близок
к магнию, поэтому свойства соединений этих элементов похожи. По растворимости
и термической устойчивости карбонат лития подобен карбонатам магния и
бериллия – элементов подгруппы IIA; эти карбонаты разлагаются при
относительно невысоких температурах вследствие более прочной связи М–О.
Соли лития лучше растворимы в органических растворителях (спиртах, эфирах,
нефтяных растворителях), чем соли других щелочных металлов. Литий (как
и магний) непосредственно реагирует с азотом, образуя Li3N
(магний образует Mg3N2),
тогда как натрий и другие щелочные металлы могут образовывать нитриды
только в жестких условиях. Металлы подгруппы IA реагируют с углеродом,
но наиболее легко протекает взаимодействие с литием (очевидно, благодаря
его малому радиусу) и наименее легко – с цезием. И наоборот, активные
щелочные металлы непосредственно реагируют с СО, образуя карбонилы (например,
K(CO)x),
а менее активные – Li и Na – только в определенных условиях.
Применение.
Щелочные металлы применяются
как в промышленности, так и в химических лабораториях, например для синтезов.
Литий используется для получения твердых легких сплавов, отличающихся,
однако, хрупкостью. Большие количества натрия расходуются для получения
сплава Na4Pb,
из которого получают тетраэтилсвинец Pb(C2H5)4
– антидетонатор бензинового топлива. Литий, натрий и кальций используются
как компоненты мягких подшипниковых сплавов. Единственный и поэтому подвижный
электрон на внешнем слое делает щелочные металлы прекрасными проводниками
тепла и электричества. Сплавы калия и натрия, сохраняющие жидкое состояние
в широком интервале температур, применяют как теплообменную жидкость в
некоторых типах ядерных реакторов и благодаря высоким температурам в ядерном
реакторе используются для производства пара. Металлический натрий в виде
подводящих электрических шин используется в электрохимической технологии
для передачи токов большой мощности. Гидрид лития LiH является удобным
источником водорода, выделяющегося в результате реакции гидрида с водой.
Литийалюминийгидрид LiAlH4
и гидрид лития используются в качестве восстановителей в органическом и
неорганическом синтезе.
Благодаря малому ионному радиусу и соответственно
высокой зарядовой плотности литий активен в реакциях с водой, поэтому
соединения лития сильно гигроскопичны, и хлорид лития LiCl используется
для осушки воздуха при эксплуатации приборов.
Гидроксиды щелочных металлов –
сильные основания, хорошо растворимые в воде; они применяются для создания
щелочной среды. Гидроксид натрия как наиболее дешевая щелочь находит широкое
применение (только в США ее расходуется в год более 2,26 млн. т).
Литий.
Самый легкий металл,
имеет два стабильных изотопа с атомной массой 6 и 7; более распространен
тяжелый изотоп, его содержание составляет 92,6% от всех атомов лития.
Литий был открыт А.Арфведсоном в 1817 и выделен Р.Бунзеном и А.Матисеном
в 1855. Он используется в производстве термоядерного оружия (водородная
бомба), для увеличения твердости сплавов и в фармацевтике. Соли лития
применяют для увеличения твердости и химической стойкости стекла, в технологии
щелочных аккумуляторных батарей, для связывания кислорода при сварке.
Натрий.
Известен с древности,
выделил его Х.Дэви в 1807. Это мягкий металл, широко применяются такие
его соединения, как щелочь (гидроксид натрия NaOH), пищевая сода (бикарбонат
натрия NaHCO3)
и кальцинированная сода (карбонат натрия Na2CO3).
Находит применение и металл в виде паров в неярких газоразрядных лампах
уличного освещения.
Калий.
Известен с древности,
выделил его также Х.Дэви в 1807. Соли калия хорошо известны: калиевая
селитра (нитрат калия KNO3),
поташ (карбонат калия K2CO3),
едкое кали (гидроксид калия KOH) и др. Металлический калий также находит
различное применение в технологии теплообменных сплавов.
Рубидий
был открыт методом спектроскопии
Р.Бунзеном в 1861; содержит 27,85% радиоактивного рубидия Rb-87. Рубидий,
как и другие металлы подгруппы IA, химически высокоактивен и должен храниться
под слоем нефти или керосина во избежание окисления кислородом воздуха.
Рубидий находит разнообразное применение, в том числе в технологии фотоэлементов,
радиовакуумных приборов и в фармацевтике.
Цезий.
Соединения цезия широко
распространены в природе, обычно в малых количествах совместно с соединениями
других щелочных металлов. Минерал поллуцит – силикат – содержит
34% оксида цезия Cs2O.
Элемент был открыт Р.Бунзеном методом спектроскопии в 1860. Основным применением
цезия является производство фотоэлементов и электронных ламп, один из
радиоактивных изотопов цезия Cs-137 применяется в лучевой терапии и научных
исследованиях.
Франций.
Последний член семейства
щелочных металлов франций настолько радиоактивен, что его нет в земной
коре в более чем следовых количествах. Сведения о франции и его соединениях
основаны на исследовании ничтожного его количества, искусственно полученного
(на высокоэнергетическом ускорителе) при a-распаде
актиния-227. Наиболее долгоживущий изотоп 22387Fr
распадается за 21 мин на 22388Ra
и b-частицы.
Согласно приблизительной оценке, металлический радиус франция составляет
2,7 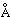 .
Франций обладает большинством свойств, характерных для других щелочных
металлов, и отличается высокой электронодонорной активностью. Он образует
растворимые соли и гидроксид. Во всех соединениях франций проявляет степень
окисления I. .
Франций обладает большинством свойств, характерных для других щелочных
металлов, и отличается высокой электронодонорной активностью. Он образует
растворимые соли и гидроксид. Во всех соединениях франций проявляет степень
окисления I.
ПОДГРУППА IIA
БЕРИЛЛИЙ, МАГНИЙ И ЩЕЛОЧНОЗЕМЕЛЬНЫЕ
МЕТАЛЛЫ – КАЛЬЦИЙ, СТРОНЦИЙ, БАРИЙ, РАДИЙ
Строго говоря, эта подгруппа состоит
из двух типов элементов. Бериллий и магний – элементы коротких периодов
– более сходны между собой, чем с другими четырьмя элементами, которые
собственно и образуют семейство щелочноземельных металлов. Фактически,
бериллий и в меньшей степени магний более сходны с первыми элементами
подгруппы IIIA.
Особенностью электронного строения любого
элемента подгруппы IIA является наличие двух электронов на внешнем слое
и внутренняя электронная структура по типу предыдущего благородного газа.
Способность отдавать два внешних валентных электрона возрастает в подгруппе
с увеличением атомного радиуса и атомного номера элемента. Максимальная
степень окисления составляет II, но имеются сведения о существовании соединений
со степенью окисления I. Такие соединения неустойчивы и диспропорционируют
с образованием свободного металла и иона М(II).
Физические
и химические свойства.
Все элементы подгруппы IIA
химически активны и поэтому в
свободном состоянии в природе не существуют. Щелочноземельные металлы
энергично реагируют с водой, вытесняя водород и образуя гидроксиды, как
и щелочные металлы. Магний взаимодействует только с кипящей водой, а бериллий
не реагирует даже с парами при высокой температуре. Бериллий отличается
от остальных элементов подгруппы и даже от магния по химическим и многим
физическим свойствам. Такое отличие характерно для всех элементов, начинающих
подгруппы А, что объясняется малым радиусом иона и соответственно высокой
зарядовой плотностью. Особенности и отличия свойств бериллия приведены
ниже.
Физические
свойства. Бериллий
– очень твердый материал
и способен оставлять царапины на стекле; твердость других элементов подгруппы
уменьшается, и барий по твердости близок к свинцу (табл. 3).
Таблица
3. БЕРИЛЛИЙ, МАГНИЙ, КАЛЬЦИЙ, СТРОНЦИЙ, БАРИЙ, РАДИЙ
Кристаллическая
структура. Различие
в физических свойствах всех металлов
этой подгруппы объясняется различием
их кристаллической структуры, а кальций имеет две модификации.
Взаимодействие
с кислотами. Все
эти элементы реагируют с разбавленными растворами минеральных кислот (типа
HCl), а бериллий растворяется менее энергично. Соли бериллия (продукты
реакций бериллия с кислотами, например, BeCl2)
имеют более ковалентную связь, чем соли других металлов этой подгруппы,
и поэтому обладают в растворе меньшей электропроводностью. В водных растворах
соли бериллия гидратированы благодаря малому радиусу иона Be2+
и сильному взаимодействию с дипольными молекулами воды. Бериллий в отличие
от других металлов плохо реагирует с азотной кислотой, так как на поверхности
образуется защитная пассивирующая пленка BeO.
Карбонаты.
Невозможно
образование BeCO3 в
растворе из-за сильного взаимодействия иона Be2+
c кислородом воды или OH–.
По той же причине и карбонат магния MgCO3,
образующийся в растворе, содержит некоторую долю ассоциированного с ним
основания Mg(OH)2.
Другие металлы образуют в этих условиях средние карбонаты. Связь Be–O
в карбонате бериллия BeОCO2
настолько прочна, что эта соль способна разлагаться на BeO и CO2.
Оксиды
и гидроксиды. При
взаимодействии с кислородом Be и Mg образуют оксиды МО, а другие, более
активные металлы, могут образовывать и пероксиды, например BaO2.
Пероксиды могут образовываться и по реакции гидроксидов Ca, Sr и Ba с
H2O2.
Растворимость гидроксидов возрастает по мере увеличения радиуса иона и
ослабления притяжения между ионом металла и гидроксид-ионом.
Комплексообразование.
Ион Be2+
обладает высоким химическим сродством к ионам или молекулам, имеющим электронную
пару. Например, 2 иона :Cl:–
предоставляют две электронные пары для образования химической связи в
:Cl:Be:Cl:, 4 электрона распределяются на 2s-
и 2p-гибридизованных
орбиталях, формируя линейное строение молекулы BeCl2
с ковалентными свойствами. Be2+
способен удерживать большее число электронных пар, образуя различные комплексные
ионы с координационным числом 4 (наиболее стабильные лиганды – гидроксид-ион,
альдегид, эфир, дикарбоновые кислоты, дикетоны). Be2+,
как и другие члены подгруппы IIA,
образует устойчивые комплексы с этилендиаминтетрауксусной кислотой (ЭДТА).
Благодаря прочности комплексов с ЭДТА эта кислота часто используется для
анализа содержания кальция и магния
(см. также
ХИМИЯ АНАЛИТИЧЕСКАЯ).
Источники
сырья и применение. Все
металлы подгруппы и их соединения находят различное промышленное применение.
Бериллий получают из минерала берилла, отделяя гидроксид от сопутствующего
алюминия. Гидроксид переводят в хлорид или фторид, и металл получают электролизом
расплава галогенида. Добавки бериллия к меди приводят к получению твердого,
не искрящего, прочного сплава, который широко используется в специальных
пружинах и инструментах для работы во взрывоопасной атмосфере. Металл
прозрачен для рентгеновского излучения и поэтому из него изготовляют окна
в рентгеновских трубках. Ядро бериллия имеет низкое поперечное сечение
захвата нейтронов, поэтому бериллий используется как оболочка урановых
стержней в ядерных реакторах.
Получение металлического магния –
важный технологический процесс. Металл трудно обрабатывать и сваривать
из-за его воспламеняемости. Многие сплавы магния находят применение в
промышленности. Чистый металл получают из морской воды или богатых рассолов
осаждением в виде Mg(OH)2.
Гидроксид прокаливают, образующийся оксид переводят в хлорид MgCl2,
который подвергают электролизу, выделяя чистый магний. Для этих же целей
можно получать оксид магния прокаливанием доломита, содержащего MgCO3.
Во время Второй мировой войны был разработан процесс получения Mg восстановлением
MgO угольной пылью и парами нефти.
См. также
МАГНИЕВАЯ ПРОМЫШЛЕННОСТЬ.
Остальные металлы этой подгруппы получают
электролизом расплавов их солей, они также имеют несколько крупных областей
применения. Так, прокаливание известняка (минерал, содержащий CaCO3,
MgCO3 и
силикаты) с целью получения оксида кальция – негашеной извести
– является многотоннажным
производством. При частичной гидратации получается гашеная известь. Оба
продукта применяются в производстве цемента, штукатурки и строительного
раствора. Сульфат кальция соcтава CaSO4Ч0,5H2O
известен как гипс, который при смешении с водой затвердевает с небольшим
расширением в результате образования CaSO4Ч2H2O.
См. также
КАЛЬЦИЙ.
Радий.
Радий
существенно отличается от остальных элементов подгруппы IIA: он радиоактивен,
при его распаде испускаются a-
и g-частицы.
По свойствам он близок к барию, особенно по растворимости (кроме растворимости
хлоридов), химической активности и физическим свойствам. Радий и его соединения
применяются в промышленности светящихся красок. Урановая смолка (урановая
руда) содержит следы радия и служит основным источником мировой добычи
радия, всего несколько сот граммов.
ПОДГРУППА IIIA. СЕМЕЙСТВО АЛЮМИНИЯ
БОР, АЛЮМИНИЙ, ГАЛЛИЙ, ИНДИЙ, ТАЛЛИЙ
Внешняя электронная конфигурация у всех
элементов подгруппы s2p1, но наличие внутренней
электронной структуры типа электронной конфигурации благородного газа
у B и Al и отсутствие ее у Ga, In и Tl, имеющих по 18 электронов, приводит
к различию свойств и делению семейства на две группы. У более легких B
и Al отличие в поведении валентных s-
и p-электронов
незначительно, и они проявляют одну стабильную степень окисления III.
С ростом атомного номера и соответственно размеров и массы увеличивается
возможность проявления меньшей степени окисления (I и II) без использования
в химической связи третьего электрона. Наиболее полно эта тенденция проявляется
в химии последнего элемента подгруппы – таллия, соединения которого
со степенью окисления I более устойчивы, чем со степенью окисления III.
Отличительной особенностью подгруппы IIIA является практически полное
отсутствие металлических свойств у бора и типичные металлические свойства
у таллия. Элементы, стоящие между ними в подгруппе, проявляют промежуточные
свойства, демонстрируя постепенный переход от неметаллических свойств
к металлическим.
Извлечение
и применение. Наиболее
распространенным и важным в промышленном отношении элементом подгруппы
является алюминий. Алюминий проявляет характерные свойства металла, такие,
как отражательная способность, проводимость, прочность, деформируемость.
Al образует ион в степени окисления III, размер и зарядовая плотность
которого обусловливают прочную связь с кислородом гидроксид-иона OH–
или воды H2O;
в последнем случае отщепляется протон H+.
Степень диссоциации образующегося Al(OH)3
небольшая, гидроксид проявляет свойства кислоты и основания. Это явление
называется амфотерностью и выражается следующим равновесием:

Al(OH)3,
как и B(OH)3,
растворяется в избытке гидроксида натрия. B(OH)3,
или H3BO3,
проявляет кислотные свойства настолько, что не растворяется в кислотах,
а Al(OH)3
легко растворяется в кислотах. Металлический алюминий получают из природного
минерала боксита (основной состав Al2O3),
который подвергают обогащению или очистке. Полученный чистый оксид добавляют
к расплаву криолита Na3AlF6
в электролизной ванне (катод), сделанной из стали, футерованной графитом.
Анодом служат стержни из углерода. В расплаве происходит восстановление
оксида до Al, который плавится. По этой технологии (процесс Холла –
Эру) получают алюминий чистотой 98%. Дальнейшую очистку алюминия проводят
повторным электролизом по методу Хупса.
См. также
АЛЮМИНИЕВАЯ ПРОМЫШЛЕННОСТЬ.
Бор в виде аморфного коричневатого
порошка получают восстановлением B2O3
активным металлом (щелочным или магнием). При этом бор загрязняется примесями
боридов, например Mg3B2.
Наиболее чистый бор получают восстановлением из BBr3
на раскаленной нити в атмосфере водорода. Другие элементы этой подгруппы
получают восстановлением их оксидов водородом или углеродом. Из всех элементов
подгруппы только алюминий получают в больших количествах для разнообразного
применения в авиационной и ракетно-космической технике, строительном деле,
мосто- и судостроении. Электрохимическое полирование металла позволяет
использовать его в производстве больших и малых зеркал. Анодирование алюминия
в присутствии органических красителей расширяет возможности его применения
в столовой утвари. В большом количестве производят оксид и сульфат алюминия.
Оксид природный и синтетический используют как абразив (алунд, корунд,
наждак – смесь с оксидами железа). Сочетание природного оксида алюминия
со следами некоторых металлических примесей придает неповторимую окраску
таким драгоценным и полудрагоценным камням, как сапфир, рубин, топаз,
аметист и изумруд. Эти драгоценные камни успешно синтезируют в лабораториях
для изготовления украшений, а также в промышленных целях. При окислении
алюминия кислородом выделяется много тепла и происходит сильный разогрев,
поэтому алюминий является хорошим восстановителем для получения металлического
железа из оксида путем прокаливания смеси Al с оксидом железа. При этом
получается расплав железа, который используют в сварке (термитный сварочный
процесс). Сульфат алюминия Al2(SO4)3
в виде простой или двойной соли (квасцы) применяют в дублении. (Квасцы
– смешанные сульфаты одновалентного и трехвалентного металлов, MI2SO4ЧMIII2(SO4)3Ч24H2O,
где MIII
– любой металл из подгруппы
IIIA, кроме бора.)
Из
данных табл. 4 видно, что наиболее необычными свойствами обладает галлий.
Металл плавится при почти комнатной температуре и сохраняет жидкое состояние
до ~2000°
С. Этот интервал жидкого состояния является максимальным среди всех известных
металлов.
Таблица
4. БОР, АЛЮМИНИЙ, ГАЛЛИЙ, ИНДИЙ, ТАЛЛИЙ
Химические
свойства. Все
элементы подгруппы
IIIA
образуют оксиды и гидроксиды со степенью окисления III, но свойства в
ряду элементов заметно различаются с изменением атомного номера. Так,
B(OH)3
– больше кислота, чем основание, а Al(OH)3
проявляет cвойства кислоты и основания в равной степени, остальные три
элемента проявляют основные свойства, а таллий даже образует растворимое
в воде сильное основание TlOH со степенью окисления I.
Галогениды
всех элементов этой подгруппы
имеют состав MX3,
а таллий кроме того образует и TlX, например TlCl, во многом сходный с
AgCl. Галогениды алюминия в жидком и даже в газообразном состоянии сильно
димеризованы. Например, хлорид алюминия является димером Al2Cl6,
в котором два тетраэдра соединены атомами хлора:

Некоторые
данные свидетельствуют от образовании AlCl в газовой фазе при высокой
температуре из смеси Al + AlCl3.
Однако образующийся монохлорид алюминия неустойчив и легко разлагается
на исходные вещества.
Галогениды бора BX3
как более тяжелые соединения не имеют такой тенденции к образованию димеров.
В галогенидах бора нет полностью завершенного октета электронов (как у
галогенидов алюминия), они являются сильными акцепторами электронов, т.е.
кислотами Льюиса. Типичный пример – трифторид бора BF3.
Ионы и молекулы – доноры электронов предоставляют электронную пару
трифториду бора, образуя с ним прочный комплексный ион, при этом в другой
части частицы-донора связи ослабевают. Например,

Галогениды
металлов подгруппы IIIA
используются как катализаторы в нефтехимической и других отраслях промышленности,
а также в лабораторных исследованиях для связывания электронной пары.
Соединения
бора. Водородные
соединения бора (бороводороды, или бораны) рассматриваются отдельно
(см.
ВОДОРОД).
Аммиачный комплекс бороводорода превращается при нагревании в боразин
B3H6N3,
который называют также неорганическим бензолом или боразолом из-за его
сходства с бензолом. Представляет интерес нитрид бора BN (боразон): при
высоких давлениях и температуре гексагональная модификация BN превращается
в алмазоподобную тетраэдрическую, отличающуюся высокой твердостью, близкой
к твердости алмаза.
ПОДГРУППА IVA. СЕМЕЙСТВО УГЛЕРОДА
– КРЕМНИЯ
УГЛЕРОД, КРЕМНИЙ, ГЕРМАНИЙ, ОЛОВО,
СВИНЕЦ
Характерная
для подгруппы IIIA особенность постепенного перехода от легкого неметаллического
элемента к тяжелому – типичному металлу наблюдается и в этой подгруппе.
Но если в подгруппе IIIA имеется один неметалл, то в данной уже два –
углерод и кремний, а остальные элементы – металлы (германий, олово,
свинец). Общие свойства элементов этой подгруппы приведены в табл. 5.
Таблица
5. УГЛЕРОД, КРЕМНИЙ, ГЕРМАНИЙ, ОЛОВО, СВИНЕЦ
Углерод,
первый
элемент подгруппы IVA периодической таблицы. В виде древесного угля и
сажи углерод был известен еще доисторическому человеку. В древнем Египте
древесный уголь получали тем же способом, что и теперь, – прокаливанием
дерева без доступа воздуха. Углерод встречается в природе в виде двух
кристаллических модификаций – алмаза и графита, а также виде многих
некристаллических форм – древесный уголь, копоть, костяная сажа.
В составе сложных соединений углерод находится в угле, нефти, он составляет
основу всех органических соединений, встречается в известняке, магнезите
и входит в состав многих неорганических соединений. В соединениях с водородом
углерод образует углеводороды (например, метан CH4,
этан C2H6,
бензол C6H6);
в соединениях с кислородом, азотом и водородом образует различные классы
веществ – кислоты, спирты, амины, кетоны и др.; в сочетании со фтором
углерод образует фторуглероды, сходные с углеводородами. Растения и живые
организмы содержат бесчисленное количество соединений углерода.
Углерод соединяется со многими металлами,
образуя карбиды (например, карбид кремния SiC, карбид кальция CaC2),
а с кислородом образует оксиды (оксид углерода(II) СО, оксид углерода(IV)
CO2
и субоксид углерода C3O2).
Оксид углерода(II) СО (монооксид углерода) – хорошо известный загрязнитель
воздуха, так как образуется при неполном сгорании большинства топлив;
он также входит в состав светильного газа и является сильным ядом для
живых существ. Оксид углерода(IV) СО2
(диоксид углерода, углекислый газ) непосредственно связан с жизненными
процессами, у животных в процессе нормального дыхания происходит связывание
углерода и кислорода в CO2,
а растения превращают CO2
снова в углерод и кислород в процессе фотосинтеза. Питьевая сода NaHCO3
при нагревании выделяет CO2.
При реакции с серой углерод образует дисульфид углерода CS2
– прекрасный растворитель для воска, жиров и масел, а также пестицид,
применяемый против крыс, сусликов и др. грызунов. Тетрахлорид углерода
CCl4
используется как пятновыводитель и в огнетушителях (как негорючее вещество).
Такие огнетушители не являются широко распространенными, так как тетрахлорид
при высоких температурах может образовывать токсичное газообразное соединение
фосген COCl2
(см. также
УГЛЕРОД).
Кремний.
Этот
элемент занимает второе место по распространенности в земной коре. Выделение
кремния из его природных источников, таких, как силикаты, – очень
сложная задача. Химическая связь кремния с кислородом очень прочная благодаря
малому ионному радиусу кремния и большой зарядовой плотности иона Si4+.
Зарядовая плотность кремния значительно больше, чем у углерода, т.к. электроны
кремния сильнее оттянуты к кислороду, создавая больший положительный заряд
у кремния. В результате образуется связь Si–O с остаточным отрицательным
зарядом у кислорода и положительным – у кремния, что не проявляется
в заметной степени у углерода и кислорода в соединении типа CO2.
Такое зарядовое распределение способствует образованию тетраэдрической
сетки связей Si–O вместо молекулярной структуры SiO2.
Схема силикатного тетраэдрического строения такова:

Свободные
связи (отмеченные отрицательным зарядом) могут соединяться или ассоциировать
с металлическими ионами типа ионов щелочных (подгруппа IA) и щелочноземельных
(подгруппа IIA) элементов, с ионами алюминия, водорода. Если же имеются
только Si–O-связи,
то получается кремнезем (SiO2)x.
Для разрыва связей Si–O и выделения элементного кремния необходим
очень эффективный восстановитель. Металлический алюминий, углерод при
высокой температуре и карбид кальция способны восстановить оксид кремния
до кремния. Более чистый кремний получают восстановлением SiBr4
водородом на раскаленной нити или с помощью металлического натрия. Соединение
кремния с железом – ферросилиций FeSi
– получается как побочный
продукт в сталелитейной промышленности, он используется как легирующая
добавка для получения кремниевых сталей. Ферросилиций получается при взаимодействии
кокса, оксида железа и силикатов.
Получение
чистого кремния.
Необходимость получения
высокочистого кремния диктуется развитием производства полупроводниковых
элементов, широко распространенных в электронной промышленности, для радиотранслирующего
и принимающего оборудования, мощных компьютеров и т.д. Чтобы получить
требуемую чистоту, порядка 99,97%, проводят зонную плавку кремния. Слиток
чистого кремния, получаемого обычным способом, медленно пропускают через
зону высокого нагрева, достаточного для плавления кремния. В слитке происходит
постепенное по его сечению плавление и рекристаллизация, при этом примеси
перемещаются, оставаясь в жидкой фазе, из-за различной растворимости их
в твердой и жидкой фазах. Кремний или металлические элементы этого семейства
легируют (введением очень малых количеств металлов подгрупп IIIA или VA)
для получения необычных проводящих и электрических свойств, которые позволяют
использовать сплавы в различных электронных устройствах. Эти сплавы можно
применять в солнечных батареях или преобразователях.
См. также
КРЕМНИЙ;
ЗОННАЯ ПЛАВКА.
Германий,
олово и свинец
получают из их оксидов
восстановлением углеродом, водородом или другими восстановителями, менее
активными, чем необходимо для получения кремния. Металлическое олово существует
в нескольких и необычных модификациях:

Реакции.
Элементы
подгруппы IVA реагируют с кислородом, образуя оксиды со степенью окисления
II и IV; свинец имеет также оксиды Pb2O3
и Pb3O4,
при этом степени окисления являются чисто формальными величинами, не отражая
истинную валентность металла. Оксид кремния(II) известен, но плохо изучен.
Весьма необычно, что ни один из двухвалентных металлов подгруппы не образует
соответствующего гидроксида M(OH)2.
Оксид свинца(IV) – самого тяжелого металла в этой подгруппе –
легко восстанавливается до оксида свинца(II). Металлический свинец и его
оксиды широко применяются в аккумуляторной технике. Оранжево-красный Pb3O4
(свинцовый сурик) используется как пигмент, как и белый основной карбонат
свинца Pb(OH)2CO3,
который иногда заменяют диоксидом титана TiO2
для тех же целей.
См. также
СВИНЕЦ;
ОЛОВО;
ОЛОВА ПРОИЗВОДСТВО;
СВИНЦА ПРОИЗВОДСТВО И ПРИМЕНЕНИЕ;
ТРАНЗИСТОР.
Образование
галогенидов.
Галогениды
элементов подгруппы IVA имеют состав MX2
и MX4;
имеются также сведения об образовании очень нестабильных MX. При термическом
разложении SiCl4
установлено образование SiCl и SiCl2.
Для углерода установлено образование всех тетрагалогенидов, тогда как
свинец не образует PbBr4
и PbI4,
поскольку Pb(IV) легко окисляет галогенид-ион в соответствии с реакцией

По
этой схеме разлагается даже фторид, поэтому PbF4
используют как фторирующий агент. Фторид олова(II) SnF2
применяется для фторирования зубной пасты.
Различие
углерода и других элементов подгруппы проявляется в способности галогенидов
тяжелых металлов образовывать комплексные ионы, принимая два галогенид-иона,
а CCl4
не способен принимать дополнительные хлорид-ионы. Тетрафторид кремния
SiF4,
принимая 2F–,
образует SiF62–,
но SiCl4
не образует SiCl62–.
Все остальные члены семейства образуют комплексные ионы типа MX62–.
Такое различие объясняется тем, что радиус атома углерода слишком мал
для координирования шести лигандов и, что более важно, на внешнем электронном
слое нет места для удерживания более четырех электронов. В случае кремния
галогениды за исключением фтора слишком велики, чтобы кремний мог их удерживать,
хотя возможности внешней электронной оболочки позволяют акцептировать
электроны для образования комплексного иона MX62–.
Этот факт находит применение при действии HF на стекло: незначительные
количества кремнезема и силикатов в стекле реагируют с HF, образуя SiF4
и H2SiF6,
при этом на стекле образуется след, происходит гравирование поверхности.
Образование
цепей. Наиболее
необычным свойством углерода является способность связывания атомов углерода
друг с другом с образованием длинных цепей. Этим свойством обладает и
кремний, но в меньшей степени, а у германия оно выражено намного слабее.
Между соединениями углерода с водородом (углеводороды) и кремния с водородом
(силаны) имеется сходство. Первый член семейства силанов – SiH4
– аналогичен метану CH4.
Силан менее термически устойчив, реагирует с водой и влагой воздуха, образуя
SiO2,
выделяя водород и другие продукты. Стабильность силанов в ряду до Si6H14
уменьшается и возрастает комплексообразующая способность. Наибольший практический
интерес представляют соединения кремния, называемые силиконами, формально
аналогичные эфирам R–O–R. Вот схема реакций образования силиконов:

Силиконовые
(кремнийорганические) полимеры обладают набором необычных свойств. Свойства
их изменяются в широких диапазонах; это могут быть водоподобные жидкости,
применяемые для аппретирования ткани и бумаги, в качестве полировочных
покрытий и даже косметических средств, и весьма вязкие и маслянистые материалы,
используемые для смазки в широком интервале температур. Некоторые кремнийорганические
полимеры оказываются полезными как пенообразователи и каучукоподобные
материалы
(см. также
КРЕМНИЙОРГАНИЧЕСКИЕ ПОЛИМЕРЫ).
Карбиды
и силициды.
При взаимодействии элементов
подгруппы IVA с углеродом образуются карбиды. Наибольшее практическое
значение имеет карбид кремния SiC, получаемый при высоких температурах
из SiO2
и кокса. Карбид кремния – очень твердый и термостабильный материал.
Его применяют в виде абразива (круги, камни и др.) и керамических электронагревателей
для создания высоких температур. Магний образует силицид магния Mg2Si,
который реагирует с кислотами, выделяя ранее упоминавшиеся силаны типа
SiH4
и Si2H6.
Силикаты.
Силикаты
некоторых металлов, например цинка и кадмия, обладают способностью излучать
свет большей длины волны, чем экспонирующий их. Такой класс материалов
называется люминофорами и используется для внутреннего покрытия люминесцентных
ламп и в технологии телевизионных трубок. Песок, кварц (особенно чистый
кремнезем SiO2)
и силикаты являются основными составляющими горных пород и глин и поэтому
применяются в технологии строительных материалов (бетон, кирпичи), стекла
и керамики
(см. также
СТЕКЛО;
КЕРАМИКА ПРОМЫШЛЕННАЯ;
ЭМАЛЬ).
Чистый кремнезем используют для изготовления
термостойких изделий, линз и другого оптического оборудования, прозрачного
в области ультрафиолетового излучения. Силикатные руды плавят и с помощью
воздушного дутья создают материал, известный как минеральная или шлаковая
вата, которая является хорошим теплоизолирующим материалом. Из кремнезема
также изготовляют фильтры и плетут стеклоткани.
ПОДГРУППА VA. СЕМЕЙСТВО АЗОТА –
ФОСФОРА
Тенденция
изменения свойств от неметаллических до металлических, которая выявлена
в подгруппах IIIA и
IVA,
характерна и для этой подгруппы. Переход к металличности (хотя и нерезкий)
начинается с мышьяка, у которого в отличие от фосфора уже заполнен 18
электронами электронный слой, расположенный под валентными электронами
(табл. 6). Однако ни As, ни Sb не имеют типичных металлических свойств,
как можно было бы ожидать у элементов с такой электронной структурой.
Полностью металлическая природа элемента проявляется в этой подгруппе
только у висмута, хотя и его металлические свойства не ярко выражены,
особенно по проводимости.
Таблица
6. АЗОТ, ФОСФОР, МЫШЬЯК, СУРЬМА, ВИСМУТ
АЗОТ
Химический
элемент азот, N, – седьмой элемент периодической таблицы элементов
и первый элемент подгруппы VA. Наиболее распространенная форма азота
– изотоп 147N,
в ядре которого содержится семь протонов и семь нейтронов. Общее содержание
этого изотопа азота в природе равно 99,635%, остальное количество (0,365%)
составляет изотоп 157N,
содержащий в ядре 7 протонов и восемь нейтронов; атомная масса азота соответственно
равна 14,008.
Около 79% (об.) азота в атмосфере состоит
из двухатомных молекул N2.
В природе существует примерный баланс азота: с одной стороны,
азот из атмосферы усваивается бактериями и расходуется в химических и
электрических (молния) процессах, а с другой, азот возвращается в атмосферу
при разложении азотсодержащих веществ.
Азот – бесцветный газ. Он имеет
ничтожную растворимость в воде, всего 23 мл/л при 0°
C и 1 атм.
Азот выделяют из воздуха сжижением.
При этом вначале азот и кислород отделяются от CO2,
паров H2O
и некоторых примесей химическими и механическими методами (адсорбция,
охлаждение,
фильтрация). При медленном нагревании жидкий воздух подвергается фракционной
перегонке и при этом азот отделяется от остающегося жидкого кислорода.
Благородные газы (He, Ne, Ar, Kr, Xe) выкипают раньше, чем азот, и, если
необходимо, их сжижают вместе.
См. также
ВОЗДУХ.
Химическая связь в молекуле азота очень
прочная, поэтому азот совершенно инертен при низких температурах. В условиях
электрического разряда или электрической дуги азот соединяется с кислородом,
образуя несколько оксидов, в основном оксид азота(II) NO и оксид азота(IV)
NO2.
Известны и другие оксиды азота, их получают по следующим реакциям:
1) оксид азота(I) N2O

2)
оксид азота(III) N2O3

3)
димер оксида азота(IV) N2O4

4)
оксид азота(V) N2O5

Аммиак.
При
высоких температуре и давлении азот соединяется с водородом на поверхности
платинового катализатора, образуя важное соединение – аммиак:

Этот
процесс (в промышленности применяют метод Габера или метод Клода) относится
к процессам фиксации азота, так как образующийся из химически инертного
молекулярного атмосферного азота аммиак способен к участию в химических
реакциях и образованию других соединений азота и может использоваться
для удобрения почвы. Количества азота в атмосфере, находящегося над 1
кв. километром земной поверхности, теоретически достаточно для получения
7 млн. т аммиака. Среди других соединений азота, пригодных в качестве
удобрений для почвы и получаемых из аммиака, известны нитрат аммония NH4NO3,
получаемый по реакции аммиака
с азотной кислотой, фосфат аммония (NH4)3PO4,
получаемый по реакции аммиака с фосфорной кислотой H3PO4,
и мочевина, образующаяся из аммиака и CO2.
Из аммиака также можно получать азотную кислоту HNO3
(окислением аммиака на воздухе с поглощением оксидов азота водой), гидразин
NH2NH2
(по реакции аммиака с гипохлоритом натрия NaOCl). Гидразин и некоторые
его производные используются в качестве ракетного топлива. Аммиак, гидразин
и азотистоводородная кислота HN3
– это гидриды азота.
Аммиак
и вода имеют ряд сходных свойств, позволяющих использовать аммиак как
растворитель для некоторых неорганических веществ. Для сравнения приведены
два процесса автоионизации аммиака и воды:

Нитриды.
При
высокой температуре азот реагирует с некоторыми металлами, образуя соединения
класса нитридов. Например,

Нитрид
магния гидролизуется:

Другие
азотсодержащие соединения.
Азот
также реагирует с карбидом кальция CaC2
при высокой температуре с образованием цианамида кальция CaCN2.
При гидролизе цианамида образуется аммиак:

Нитрат
натрия NaNO3,
известный как чилийская селитра, добывается в больших количествах в Чили.
Он используется как сырье для производства азотной кислоты по следующей
реакции:

Азот,
образуя связь с углеродом, входит в состав многих природных органических
соединений, например аминокислот RCHNH2COOH,
аминов RNH2
и амидов RCONH2
(см.
также АЗОТ).
ФОСФОР, МЫШЬЯК, СУРЬМА, ВИСМУТ
Получение.
Некоторые
элементы этой подгруппы встречаются в свободном состоянии и известны с
древних времен; они относительно легко получаются из их оксидов или сульфидов.
Сурьма иногда встречается в свободном состоянии, а другие элементы –
в основном в виде оксидов или сульфидов и реже в соединениях с другими
неметаллами (см.
табл. 6). Фосфор занимает 12-е место по распространенности элементов в
природе. Он входит в состав многих горных пород и содержится в живых организмах
(в костях, зубах и т.д.). Фосфор впервые был выделен из человеческой мочи.
Химические связи P–O в фосфат-ионе PO43–одни
из наиболее прочных, поэтому для получения свободного фосфора требуются
большие затраты энергии. В промышленности фосфор получают при прокаливании
смеси фосфата кальция, оксида кремния(IV) (песка) и кокса при высокой
температуре в соответствии с реакцией
Ca3(PO4)2
+ 3SiO2
+ 5C ®
3CaSiO3
+ 0,5P4
+ 5CO
Фосфор
возгоняют и плавят, в результате образуется белая модификация фосфора,
которую хранят под слоем холодной воды (с холодной водой он не реагирует).
Другие элементы этого семейства получают из оксидов восстановлением углеродом.
Аллотропия.
Все
элементы подгруппы, встречающиеся в свободном состоянии, имеют аллотропные
модификации (состояния с различной кристаллической или атомной структурой
вещества). С ростом атомного номера многообразие и сложность модификаций
постепенно уменьшаются. У фосфора известны более 10 аллотропических модификаций,
из которых наиболее важные – белый, красный и черный фосфор; взаимопревращения
между ними представлены следующей схемой:

Отметим
некоторые различия в свойствах. Белая модификация как более реакционноспособная
активно реагирует с молекулярным кислородом, поэтому белый фосфор применяют
в устройствах для воспламенения. Он растворим в CS2, но нерастворим в холодной воде. Белый фосфор очень ядовит, вызывает сильные
ожоги и работа с ним требует особой осторожности. Белый фосфор имеет тетраэдрическое
строение, компактность такой молекулы объясняет высокую летучесть фосфора.
Ковалентные связи в тетраэдре не очень прочные, чем и объясняется образование
оксидов, некоторых сульфидов и других соединений.
Красная модификация фосфора значительно
менее реакционноспособна, чем белая; красный фосфор нерастворим в любых
растворителях (как и черный), воде и не так ядовит. Структура ближе к
форме связанных треугольников, чем к тетраэдру. Соединения, образуемые
из белого или красного фосфора, идентичны. Черный фосфор обладает металличностью
– некоторой проводимостью и блеском. Мышьяк образует аллотропные
модификации, частично подобные модификациям фосфора. Сурьма существенно
отличается от фосфора и мышьяка, а висмут демонстрирует многие свойства,
характерные для металлических структур.
Применение.
Фосфор
применяется в основном для химических синтезов, другие элементы находят
применение в технологии сплавов. Сурьму добавляют к свинцу для увеличения
твердости; сплавы, содержащие до 12% (масс.) сурьмы, применяют в производстве
аккумуляторов. Сплавы свинца с висмутом, как и с другими элементами этого
семейства, используют в производстве легкоплавких материалов, например,
сплава Вуда (Pb, Bi, Sn, Cd). Соединения мышьяка являются инсектицидами.
Фосфид натрия (Na3P),
синтезируемый из элементов, применяют для изготовления морских сигнальных
огней. При реакции фосфидов с водой образуется ядовитое вещество фосфин
PH3,
запах которого часто обнаруживается при реакции цинка или железа с HCl
в водной среде, так как фосфиды могут присутствовать как примеси.
Реакции.
Для всех элементов
подгруппы характерно общее строение внешнего электронного слоя ns2np3,
однако трудно достаточно точно предсказать химические свойства элементов.
Азот проявляет все степени окисления от –III до V, у фосфора (см.
табл. 6) реализуются почти все степени окисления от –III до V. Разнообразие
степеней окисления уменьшается с ростом массы элемента; висмут в степени
окисления V неустойчив, легко восстанавливается до степени окисления III,
основной для висмута. В особых условиях все же можно получить соединения
этих элементов с необычными степенями окисления. Азот может принимать
только 8 электронов от 4 доноров, а остальные элементы являются акцепторами
10, 12 и более электронов (от 5, 6 и более доноров или лигандов). Однако
в этом у них мало общего, определенные сходства и различия более четко
проявляются при рассмотрении соединений этих элементов.
Оксиды.
Кроме
азота, все элементы подгруппы VA
активно реагируют с кислородом, фосфор образует оксид P(V) P4O10,
а другие, более тяжелые элементы – только оксиды в степени окисления
III. Более легкие элементы образуют оксиды тетраэдрического строения.
Для мышьяка и сурьмы кроме As4O6
и Sb4O6
известны также As2O5,
Sb2O4
и Sb2O5,
но структуры их недостаточно изучены. As2O5
и Sb2O5
получают дегидратацией соответствующих кислот, H3AsO4
и HSb(OH)6.
Sb2O4
образуется при прокаливании Sb4O6
или Sb2O5
на воздухе.
Кислоты.
Фосфорные
кислоты легко получаются при растворении оксидов фосфора. Схема образования
многообразных кислот и солей фосфора приведена ниже:

В
этой схеме отсутствует фосфорноватистая (гипофосфористая) кислота H3PO2
(сильный восстановитель, образуется в небольших количествах при реакции
белого фосфора с кипящей водой), а также фосфорноватая (гипофосфорная)
кислота H4P2O6
(получается по реакции красного фосфора с NaOCl в кислой среде). Ниже
приводятся структурные формулы некоторых кислот фосфора:

Кислоты
других элементов, проявляющих больше металлических свойств, отчасти сходны
по форме, однако с ростом молекулярной массы уменьшается способность атомов
образовывать прочные двойные связи (такие, как P=O). Поэтому образуются
одиночные OH-группы, например, состав ортосурьмяной кислоты – HSb(OH)6,
а не H3SbO4.
Фосфорные
кислоты и их соли находят многочисленные применения в промышленности.
Средние фосфаты и полифосфаты Na3P3O6
и более сложного состава
применяют в многотоннажном производстве моющих средств, в процессах умягчения
и очистки воды. Фосфат кальция CaH4P2O8
применяют при изготовлении муки и в качестве заменителя дрожжей. Ca3P2O8
применяют в производстве зубных порошков и паст, пирофосфаты расходуются
для изготовления буровых растворов, в стекольном производстве, в водоподготовке,
для очистки металлов и антикоррозионной защиты. Тысячи тонн фосфатов используют
как удобрение в сельском хозяйстве: практически нерастворимый Ca3(PO4)2
переводят в растворимую форму Ca(H2PO4)2
добавлением серной или азотной кислоты, причем при использовании азотной
кислоты в почву вводится помимо фосфора также и азот в усвояемой форме.
Сульфиды.
Сера
реагирует непосредственно со всеми элементами подгруппы VA,
с фосфором образуются P4S3,
P4S7,
P4S5,
а с P4O10
образуется оксосульфид P4O6S2.
P4S3
используют для производства легковоспламеняющихся (небезопасных) спичек,
а для изготовления безопасных спичек применяют смесь P4S3
и Sb2S3:
сульфид сурьмы входит в состав спичечной головки вместе с окислителем
KClO3,
а смесь P4S3
и Sb2S3
с песком покрывает боковую
поверхность спичечного коробка. Существование As2S5
и Sb2S5
не установлено надежно,
а образующийся Bi2S5
самопроизвольно разлагается
на S и Bi2S3.
Гидриды.
Изменения
свойств гидридов элементов этой подгруппы вполне предсказуемы. Аммиак
NH3
– стабильное соединение со слабыми основными свойствами (донор электронной
пары), а в жидком состоянии – слабый донор H+.
Устойчивость гидридов в подгруппе убывает с увеличением атомного номера,
ослабевают донорные способности электронной пары, но возрастает способность
к отщеплению водорода; получить BiH3
не просто.
Галогениды.
В
ряду галогенидов систематичности свойств не наблюдается. Только BiF3
является ионным соединением, что связано с максимальной металличностью
висмута в этой подгруппе элементов. Все элементы образуют галогениды состава
MX3,
а фосфор также и P2Cl4
и P2I4.
Среди галогенидов MX5
не установлено образование AsCl5,
а висмут образует только BiF5,
легко разлагающийся на F2
и BiF3
(поэтому BiF5 –
хороший фторирующий агент). Фосфор несмотря на малый радиус способен образовывать
PCl5
и даже PBr5.
Устойчивость этих галогенидов фосфора объясняется слабым окислительным
действием P(V) в отличие от Bi(V), а также особенностями строения галогенида
(в случае хлорида PCl4+
PCl6–).
Галогениды MX3
несмотря на наличие неподеленной электронной пары не образуют аддуктов
по донорно-акцепторному механизму. Все галогениды энергично реагируют
с водой (гидролиз), например:
PCl3
+ 3H2O
® P(OH)3
+ 3HCl
Однако
гидролиз галогенидов азота(III) протекает иначе, чем у галогенидов остальных
элементов этой группы, например:
Взаимодействие
с кислотами.
Элементы этой группы
по-разному реагируют с кислотами. Ни один из них самопроизвольно не взаимодействует
с HCl с выделением водорода. Кислоты-окислители, такие, как HNO3,
реагируют с As и Sb; сурьма при длительной обработке образует Sb2O4.
Висмут растворяется в азотной кислоте, образуя нитрат Bi(NO3)3.
Сульфаты мышьяка, сурьмы и висмута можно получать при растворении соответствующих
оксидов в серной кислоте.
См. также
ФОСФОР;
МЫШЬЯК;
СПИЧКИ.
ПОДГРУППА VIA. ХАЛЬКОГЕНЫ
КИСЛОРОД
Элемент
кислород O – восьмой элемент периодической системы элементов и первый
элемент подгруппы VIA (табл. 7а). Этот элемент наиболее распространен
в земной коре, составляя около 50% (масс.). В воздухе, которым мы дышим,
находится ~20%
кислорода в свободном (несвязанном) состоянии, и 88% кислорода находится
в гидросфере в связанном состоянии в виде воды H2O.
Таблица
7а. КИСЛОРОД, СЕРА, СЕЛЕН, ТЕЛЛУР, ПОЛОНИЙ
Наиболее
распространен изотоп 168O.
Ядро такого изотопа содержит 8 протонов и 8 нейтронов. Существенно менее
распространен (0,2%) изотоп c 10 нейтронами, 188O.
Еще менее распространен (0,04%) изотоп с 9 нейтронами, 178O.
Средневзвешенная масса всех изотопов равна 16,044. Так как атомная масса
изотопа углерода с массовым числом 12 равно точно 12,000 и все другие
атомные массы основаны на этом стандарте, то атомная масса кислорода по
этому стандарту должна быть равна 15,9994.
Кислород – двухатомный газ, как
водород, азот и галогены фтор, хлор (бром и иод тоже образуют двухатомные
молекулы, но они не газы). Б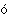 льшую
часть кислорода, используемого в промышленности, получают из атмосферы.
Для этого разработаны относительно недорогие методы сжижения химически
очищенного воздуха с помощью циклов сжатия и охлаждения. Сжиженный воздух
медленно нагревают, при этом более летучие и легко испаряемые соединения
выделяются, а жидкий кислород накапливается. Такой метод называется фракционной
перегонкой или ректификацией жидкого воздуха. При этом неизбежно загрязнение
кислорода примесью азота, и для получения высокочистого кислорода процесс
ректификации повторяют до полного удаления азота. См.
также ВОЗДУХ. льшую
часть кислорода, используемого в промышленности, получают из атмосферы.
Для этого разработаны относительно недорогие методы сжижения химически
очищенного воздуха с помощью циклов сжатия и охлаждения. Сжиженный воздух
медленно нагревают, при этом более летучие и легко испаряемые соединения
выделяются, а жидкий кислород накапливается. Такой метод называется фракционной
перегонкой или ректификацией жидкого воздуха. При этом неизбежно загрязнение
кислорода примесью азота, и для получения высокочистого кислорода процесс
ректификации повторяют до полного удаления азота. См.
также ВОЗДУХ.
При температуре –182,96°
С и давлении 1 атм кислород из бесцветного газа превращается в жидкость
бледноголубого цвета. Наличие окраски свидетельствует о том, что вещество
содержит молекулы с неспаренными электронами. При –218,7°
C кислород твердеет. Газообразный О2
в 1,105 раз тяжелее воздуха, и при 0°
C и 1 атм 1 л кислорода имеет массу 1,429 г. Газ слабо растворим в воде
(~0,30
см 3/л
при 20°
C), но это важно для существования жизни в воде.
Большие массы кислорода используют в
сталелитейной промышленности для быстрого удаления нежелательных примесей,
прежде всего углерода, серы и фосфора, в виде оксидов в процессе обдувки
или непосредственно продувкой кислорода через расплав. Одно из важных
применений жидкого кислорода – в качестве окислителя ракетного топлива.
Кислород, хранящийся в баллонах, применяют в медицине для обогащения воздуха
кислородом, а также в технике при сварке и резке металлов.
Образование
оксидов.
Металлы и неметаллы реагируют с кислородом с образованием оксидов. Реакции
могут происходить с выделением большого количества энергии и сопровождаться
сильным свечением, вспышкой, горением. Свет фотовспышки образуется при окислении
алюминиевой или магниевой фольги или проволоки. Если при окислении образуются
газы, то в результате выделения тепла реакции они расширяются и могут стать
причиной взрыва.
Не все элементы реагируют с кислородом
с выделением тепла. Оксиды азота, например, образуются с поглощением тепла.
Кислород реагирует с элементами, образуя
оксиды соответствующих элементов а) в обычной либо б) в высокой степени
окисления. Дерево, бумага и многие природные вещества или органические
продукты, содержащие углерод и водород, сгорают по типу (а), образуя,
например, CO, или по типу (б), образуя CO2.
Озон.
Кроме
атомарного (одноатомного) кислорода O и молекулярного (двухатомного) кислорода
O2
существует озон – вещество, молекулы которого состоят из трех атомов
кислорода O3.
Эти формы являются аллотропными модификациями. Пропуская тихий электрический
разряд через сухой кислород, получают озон:
3O2
 2O3
2O3
Озон
обладает резким раздражающим запахом и часто обнаруживается вблизи электрических
двигателей или генераторов тока.
Озон
при тех же температурах химически более активен, чем кислород. Он обычно
реагирует с образованием оксидов и выделением свободного кислорода, например:
Hg
+ O3
® HgO +
O2
Озон
эффективен для очистки (дезинфекции) воды, для отбеливания тканей, крахмала,
очистки масел, при сушке и выдержке древесины и чая, в производстве ванилина
и камфоры.
См.
КИСЛОРОД.
СЕРА, СЕЛЕН, ТЕЛЛУР, ПОЛОНИЙ
При переходе от кислорода к полонию
в подгруппе VIA
изменение свойств от неметаллических к металлическим выражено слабее,
чем у элементов подгруппы VA. Электронное строение ns2np4
халькогенов предполагает скорее прием электронов, чем их отдачу. Частичное
оттягивание электронов от активного металла к халькогену возможно с образованием
соединения с частично ионным характером связи, однако не такой степени
ионности, как аналогичное соединение с кислородом. Тяжелые металлы образуют
халькогениды с ковалентной связью, соединения окрашены и совершенно нерастворимы.
Молекулярные
формы. Образование
октета электронов вокруг каждого атома выполняется в элементном состоянии
за счет электронов соседних атомов. В результате, например, в случае серы
получается циклическая молекула S8,
построенная по типу короны. Между молекулами прочной связи нет, поэтому
сера при невысоких температурах плавится, кипит и испаряется. Аналогичные
строение и набор свойств имеет селен, образующий молекулу Se8;
теллур, возможно, образует цепочки Te8,
но эта структура точно не установлена. Не ясна также и молекулярная структура
полония. Сложность строения молекул определяет различные формы их существования
в твердом, жидком и газообразном состоянии (аллотропия) – это свойство,
очевидно, является отличительной особенностью халькогенов среди других
групп элементов. Наиболее устойчивой формой серы является a-форма,
или ромбическая сера; вторая метастабильная форма – b,
или моноклинная сера, которая может превращаться в a-серу
при хранении. Другие модификации серы приведены на схеме:

a-Cера
и b-сера
растворимы в CS2.
Известны и другие формы серы. m-Форма
– вязкая
жидкость, вероятно, образуется из структуры «корона», чем и объясняется
ее резиноподобное состояние. При резком охлаждении или конденсации паров
серы образуется порошковая сера, которую называют «серный цвет». Пары,
а также пурпуровый порошок, получаемый резким охлаждением паров, по результатам
исследований в магнитном поле, содержит неспаренные электроны. Для Se
и Te аллотропия менее характерна, но имеет общее сходство с серой, причем
модификации селена аналогичны модификациям серы.
Реакционная
способность. Все
элементы VIA подгруппы реагируют с одноэлектронными донорами (щелочные
металлы, водород, метильный радикал ЧCH3),
образуя соединения состава RMR, т.е. проявляя координационное число 2,
– например, HSH, CH3SCH3,
NaSNa и ClSCl. Шесть валентных электронов координируются вокруг атома
халькогена, два – на валентной s-оболочке
и четыре – на валентной p-оболочке.
Эти электроны могут участвовать в образовании связи с более сильным акцептором
электронов (например, кислородом), который оттягивает их с образованием
молекул и ионов. Таким образом, эти халькогены проявляют степени окисления
II, IV, VI, образуя преимущественно ковалентные связи. В семействе халькогенов
проявление степени окисления VI ослабевает с увеличением атомного номера,
так как электронная пара ns2
все слабее участвует в образовании связей у более тяжелых элементов (эффект
инертной пары). К соединениям с такими степенями окисления относятся SO
и H2SO2
для серы(II); SO2
и H2SO3
для серы(IV); SO3
и H2SO4
для серы(IV). Аналогичные составы имеют соединения и других халькогенов,
хотя есть некоторые различия. Сравнительно немного существует и нечетных
степеней окисления.
Методы извлечения свободных элементов
из природного сырья различны для разных халькогенов. Известны большие
месторождения свободной серы в горных породах, в отличие от незначительных
количеств других халькогенов в свободном состоянии. Осадочную серу можно
добывать геотехнологическим методом (фраш-процесс): перегретую воду или
пар закачивают по внутренней трубе для плавления серы, затем расплавленную
серу сжатым воздухом выдавливают на поверхность через внешнюю концентрическую
трубу. Таким способом получают чистую дешевую серу на месторождениях в
Луизиане и под Мексиканским заливом у побережья Техаса. Селен и теллур
извлекают из газовых выбросов металлургии меди, цинка и свинца, а также
из шламов электрометаллургии серебра и свинца. Некоторые заводы, на которых
концентрируется селен, становятся источниками отравления животного мира.
Свободная сера находит большое применение
в сельском хозяйстве как порошковый фунгицид. Только в США около 5,1 млн
т. серы используется ежегодно для различных процессов и химических технологий.
Много серы расходуется в производстве серной кислоты.
Отдельные классы соединений халькогенов,
особенно галогениды, сильно различаются по свойствам.
Водородные
соединения. Водород
медленно реагирует с халькогенами, образуя гидриды H2M.
Существует большая разница между водой (гидрид кислорода) и гидридами
других халькогенов, которые обладают отвратительным запахом и ядовиты,
а их водные растворы представляют собой слабые кислоты (самая сильная
из них – H2Te).
Металлы непосредственно реагируют с халькогенами с образованием халькогенидов
(например, сульфид натрия Na2S,
сульфид калия K2S).
Сера в водных растворах этих сульфидов образует полисульфиды (например,
Na2Sx).
Гидриды халькогенов могут быть вытеснены из подкисленных растворов сульфидов
металлов. Так, из подкисленных растворов Na2Sx
выделяются сульфаны H2Sx
(где x
может быть больше
50; однако изучены только сульфаны
с x
Ј 6).
Галогениды.
Халькогены непосредственно
реагируют с галогенами, образуя галогениды различного состава. Ассортимент
реагирующих галогенов и устойчивость образующихся соединений зависит от
соотношения радиусов халькогена и галогена. Возможность образования галогенида
с высокой степенью окисления халькогена убывает с увеличением атомной
массы галогена, так как галогенид-ион будет окисляться до галогена, а
халькоген – восстанавливаться до свободного халькогена или галогенида
халькогена в низкой степени окисления, например:
TeI6
® TeI4
+ I2
Степень
окисления I для серы, возможно, реализуется в соединении (SCl)2
или S2Cl2
(этот состав установлен недостаточно надежно). Наиболее необычным из галогенидов
серы является SF6,
отличающийся высокой инертностью. Сера в этом соединении настолько прочно
экранирована атомами фтора, что даже наиболее агрессивные вещества практически
не действуют на SF6.
Из табл. 7б следует, что сера и селен не образуют иодидов.
|
Таблица 7б.
ГАЛОГЕНИДЫ ХАЛЬКОГЕНОВ
|
| |
Cера
|
Селен
|
Теллур
|
| Фториды |
SF2, SF4, S2F10,
SF6 |
SeF4, SeF6 |
TeF4, TeF6 |
| Хлориды |
S2Cl2, SCl2,
SCl4 |
Se2Cl2, SeCl4 |
TeCl2, TeCl4 |
| Бромиды |
S2Br2 |
Se2Br2, SeBr4 |
TeBr2, TeBr4 |
| Иодиды |
–
|
–
|
TeI4 |
Известны
комплексные галогениды халькогенов, которые образуются при взаимодействии
галогенида халькогена с галогенид-ионами, например, TeCl4
+ 2Cl–
= TeCl62–.
Оксиды
и оксокислоты. Оксиды
халькогенов образуются
при прямом взаимодействии с кислородом. Сера сгорает на воздухе или в
кислороде с образованием SO2
и примеси SO3.
Для получения SO3 используют
другие методы. При взаимодействии SO2
с серой возможно образование SO. Селен и теллур образуют аналогичные оксиды,
но они имеют существенно меньшее значение на практике. Электрические свойства
оксидов селена и, особенно, чистого селена определяют рост их практического
применения в электронике и электротехнической промышленности. Сплавы железа
с селеном являются полупроводниками и применяются для изготовления выпрямителей.
Поскольку проводимость селена зависит от освещенности и температуры, это
свойство используется при изготовлении фотоэлементов и температурных датчиков.
Триоксиды известны для всех элементов этой подгруппы, кроме полония. Каталитическое
окисление SO2
до SO3
лежит в основе промышленного получения
серной кислоты. Твердый SO3
имеет аллотропические модификации: перьевидные кристаллы, асбестоподобную
структуру, льдоподобную структуру и полимерную циклическую (SO3)3.
Селен и теллур растворяются в жидком SO3,
образуя межхалькогенные соединения типа SeSO3
и TeSO3.
Получение SeO3
и TeO3
сопряжено с определенными трудностями. SeO3
получают из газовой смеси
Se и O2
в разрядной трубке, а TeO3
образуется при интенсивной дегидратации H6TeO6.
Упомянутые оксиды гидролизуются или энергично реагируют с водой, образуя
кислоты. Наибольшее практическое значение имеет серная кислота. Для ее
получения применяют два процесса – постоянно развивающийся контактный
метод и устаревший башенный нитрозный метод (см.
также СЕРА).
Серная кислота является сильной кислотой;
она активно взаимодействует с водой с выделением тепла по реакции
H2SO4
+ H2O
 H3O+
+ HSO4– H3O+
+ HSO4–
Поэтому
следует соблюдать осторожность при разбавлении концентрированной серной
кислоты, так как перегрев может вызвать выброс паров из емкости с кислотой
(ожоги от серной кислоты часто связаны с добавлением в нее малого количества
воды). Благодаря высокому сродству к воде H2SO4
(конц.) интенсивно взаимодействует
с хлопковой одеждой, сахаром и живыми тканями человека, отнимая воду.
Огромные количества кислоты
используют для поверхностной обработки металлов, в сельском хозяйстве
для получения суперфосфата
(см. также
ФОСФОР),
при переработке сырой нефти до стадии ректификации, в технологии полимеров,
красителей, в фармацевтической промышленности и многих других отраслях.
Серная кислота – наиболее важное неорганическое соединение с промышленной
точки зрения. Оксокислоты халькогенов приведены в табл. 7в. Следует отметить,
что некоторые кислоты существуют только в растворе, другие – только
в виде солей.
|
Таблица 7в.
ОКСОКИСЛОТЫ ХАЛЬКОГЕНОВ
|
| Cера |
Селен
|
Теллур
|
| H2SO2 –
сульфоксиловая |
H2SeO3 – селенистая |
H2TeO3 – теллуристая |
| H2SO3 –
сернистая |
|
H2Te2O5
– дителлуристая (только соли) |
| H2S2O5
– пиросернистая (дисернистая) |
|
|
| H2S2O4
– серноватистая (гипосернистая) |
|
|
| H2SO4 – серная |
H2SeO4 –
селеновая |
(H2TeO4)x
– аллотеллуровая |
| H2S2O7
– пиросерная |
|
H6TeO6 – ортотеллуровая |
| H2S2O3
– тиосерная |
|
|
| H2S2O6
– дитионовая |
|
|
| H2S3O6
– тритионовая |
|
|
| H2SnO6
– политионовая |
|
|
| H2SO5 (H2SO3[O]2
) – пероксомоносерная (мононадсерная,
моноперсерная, кислота Каро) |
|
|
| H2S2O8
– пероксодисерная |
|
|
Среди
остальных оксокислот серы важное место в промышленности занимает сернистая
кислота H2SO3,
образующаяся при растворении SO2
в воде слабая кислота, существующая только в водных растворах. Ее соли достаточно
стабильны. Кислота и ее соли являются восстановителями и используются как
«антихлораторы» для удаления избыточного хлора из отбеливателя.
Тиосерная кислота и ее соли применяются
в фотографии для удаления избытка непрореагировавшего AgBr из фотопленки:
AgBr
+ S2O32–
 [Ag(S2O3)]–
+ Br–
[Ag(S2O3)]–
+ Br–
Название
«гипосульфит натрия» для натриевой соли тиосерной кислоты является неудачным,
правильное название – «тиосульфат» – отражает структурную
связь этой кислоты с серной кислотой, в которой один атом негидратированного
кислорода замещен на атом серы («тио»).
Политионовые
кислоты представляют интересный класс соединений, в котoром образуется
цепочка атомов серы, расположенная между двумя группами SO3.
Имеется много данных о производных H2S2O6,
но политионовые кислоты могут содержать и большое число атомов серы.
Пероксокислоты важны не только как окислители,
но и как промежуточные соединения для получения пероксида водорода. Пероксодисерная
кислота получается при электролитическом окислении иона HSO4–
на холоду. Пероксосерная кислота образуется при гидролизе пероксодисерной
кислоты:
2HSO4–
® H2S2O8
+ 2e–
H2S2O8
+ H2O
® H2SO5
+ H2SO4
Ассортимент
кислот селена и теллура существенно меньше. Селенистая кислота H2SeO3
получается при испарении воды из раствора SeO2.
Она является окислителем в отличие от сернистой кислоты
H2SO3
(восстановитель)
и легко окисляет галогениды до галогенов. Электронная пара 4s2
селена неактивно участвует в образовании связи (эффект инертной пары;
см. выше
в разделе о реакционной способности серы), и поэтому селен легко переходит
в элементное состояние. Селеновая кислота по той же причине легко разлагается
с образованием H2SeO3
и Se. Атом Te имеет больший
радиус и поэтому малоэффективен при образовании двойных связей. Поэтому
теллуровая кислота не существует в обычной форме

а
6 гидроксогрупп координируются теллуром с образованием H6TeO6,
или Te(OH)6.
Оксогалогениды.
Оксокислоты и оксиды
халькогенов реагируют с галогенами и PX5,
образуя оксогалогениды состава MOX2
и MO2X2.
Например, SO2
реагирует с PCl5,
образуя SOCl2
(тионилхлорид):
PCl5
+ SO2
® POCl3
+ SOCl2
Cоответствующий
фторид SOF2
образуется при взаимодействии SOCl2
и SbF3,
а тионилбромид SOBr2
– из SOCl2
и HBr.
Сульфурилхлорид
SO2Cl2
получается при хлорировании хлором
SO2
(в присутствии камфоры), аналогично получают сульфурилфторид SO2F2.
Хлорофторид SO2ClF
образуется из SO2Cl2,
SbF3
и SbCl3.
Хлорсульфоновая кислота HOSO2Cl
получается при пропускании хлора через дымящую серную кислоту. Аналогично
образуется и фторсульфоновая кислота. Известны также оксогалогениды селена
SeOCl2,
SeOF2,
SeOBr2.
Азот-
и серусодержащие соединения.
Сера образует разные
соединения с азотом, многие из которых мало изучены. При обработке S2Cl2
аммиаком образуется N4S4
(тетранитрид тетрасеры), S7HN
(имид гептасеры) и другие соединения. Молекулы S7HN
построены как циклическая молекула
S8,
в которой один атом серы замещен на азот. N4S4
образуется также из серы и аммиака.
Он превращается в тетраимид тетрасеры S4N4H4
при действии олова и хлороводородной
кислоты. Промышленное значение имеет другое азотпроизводное – сульфаминовая
кислота NH2SO3H
– белое, негигроскопичное кристаллическое вещество. Она получается
при взаимодействии мочевины или аммиака с дымящей серной кислотой. Эта
кислота по силе близка к серной кислоте. Ее аммониевая соль NH4SO3NH2
используется как ингибитор горения, а соли щелочных металлов – как
гербициды.
Полоний.
Несмотря на ограниченное
количество полония, химия этого последнего элемента подгруппы VIA изучена
относительно неплохо благодаря использованию его свойства радиоактивности
(обычно в химических реакциях он смешивается с теллуром как носителем
или сопутствующим реагентом). Период полураспада наиболее устойчивого
изотопа 210Po
составляет всего 138,7 сут, поэтому понятны трудности его изучения. Для
получения 1 г Po требуется переработать более 11,3 т урановой смолки.
210Po
можно получить нейтронной бомбардировкой 209Bi,
который сначала переходит в 210Bi,
а затем выбрасывает b-частицу,
образуя 210Po.
По-видимому, полоний проявляет такие же степени окисления, как и другие
халькогены. Синтезированы гидрид полония H2Po,
оксид PoO2,
известны соли со степенями окисления II и IV. Очевидно, PoO3
не существует.
ПОДГРУППА VIIA. ГАЛОГЕНЫ
ФТОР, ХЛОР, БРОМ, ИОД, АСТАТ
Галогены
и особенно фтор, хлор и бром имеют большое значение для промышленности
и лабораторной практики как в свободном состоянии, так и в виде различных
органических и неорганических соединений. Фтор – бледножелтый высокореакционноспособный
газ, вызывающий раздражение дыхательных путей и коррозию материалов. Хлор
– тоже едкий, химически агрессивный газ темного зеленовато-желтого
цвета – менее реакционноспособен по сравнению со фтором. Он широко
используется в малых концентрациях для дезинфекции воды (хлорирование),
а в больших концентрациях ядовит и вызывает сильное раздражение дыхательных
путей (газообразный хлор применяли как химическое оружие в Первой мировой
войне). Бром – тяжелая красно-коричневая жидкость при обычных условиях,
но легко испаряется, превращаясь в едкий газ. Иод – темнофиолетовое
твердое вещество, легко сублимирующееся. Астат – радиоактивный элемент,
единственный галоген, не имеющий стабильного изотопа.
В семействе этих элементов по сравнению
с другими А-подгруппами наиболее выражены неметаллические свойства. Даже
тяжелый иод – типичный неметалл. Первый член семейства, фтор, проявляет
«сверхнеметаллические» свойства. Все галогены – акцепторы электронов,
и у них сильно выражена тенденция к завершению октета электронов путем
принятия одного электрона. Реакционная способность галогенов уменьшается
с ростом атомного номера, и в целом свойства галогенов изменяются в соответствии
с их положением в периодической таблице. В табл. 8а приведены некоторые
физические свойства, позволяющие понять отличия и закономерность изменения
свойств в ряду галогенов. Фтор проявляет во многом необычные свойства.
Например, установлено, что сродство к электрону у фтора не так высоко,
как у хлора, а это свойство должно указывать на способность принимать
электрон, т.е. на химическую активность. Фтор же ввиду очень малого радиуса
и близости валентной оболочки к ядру должен обладать наивысшим сродством
к электрону. Это несоответствие, по крайней мере отчасти, объясняется
необычно малой энергией связи F–F по сравнению с этой величиной
для Cl–Cl (см.
энтальпию диссоциации в табл. 8а). Для фтора она равна 159 кДж/моль, а
для хлора 243 кДж/моль. Из-за малого ковалентного радиуса фтора близость
неподеленных электронных пар в структуре :F:F: определяет легкость разрыва
этой связи. Действительно, фтор химически более активен, чем хлор, благодаря
легкости образования атомарного фтора. Величина энергии гидратации (см.
табл. 8а) указывает на высокую реакционную способность фторид-иона: ион
F–
гидратируется с б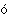 льшим
энергетическим эффектом, чем другие галогены. Маленький радиус и соответственно
более высокая зарядовая плотность объясняют б льшим
энергетическим эффектом, чем другие галогены. Маленький радиус и соответственно
более высокая зарядовая плотность объясняют б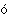 льшую
энергию гидратации. Многие необычные свойства фтора и фторид-иона становятся
понятными при учете размера и заряда иона. льшую
энергию гидратации. Многие необычные свойства фтора и фторид-иона становятся
понятными при учете размера и заряда иона.
Таблица
8а. ФТОР, ХЛОР, БРОМ, ИОД, АСТАТ
Получение.
Большое
промышленное значение галогенов предъявляет определенные требования к
методам их производства. С учетом разнообразия и сложности методов получения
существенное значение имеют расход и стоимость электроэнергии, сырья и
потребности в побочных продуктах.
Фтор.
Из-за
химической агрессивности фторид- и хлорид-ионов эти элементы получают
электролитическим путем. Фтор получают из флюорита: CaF2
при обработке серной кислотой образует HF (плавиковая кислота); из HF
и KF синтезируют KHF2,
который и подвергают электролитическому окислению в электролизере с раздельными
анодным и катодным пространствами, со стальным катодом и угольным анодом;
на аноде выделяется фтор F2,
а на катоде – побочный продукт водород, который следует изолировать
от фтора во избежание взрыва. Для синтеза таких важных соединений, как
полифторуглеводороды, в электролизере выделяющимся фтором фторируют органические
соединения, благодаря чему не требуются изоляция и накапливание фтора
в отдельных емкостях.
Хлор
производят
в основном из рассола NaCl в электролизерах с отделенным анодным пространством
для предотвращения реакции хлора с другими продуктами электролиза: NaOH
и H2;
таким образом, в результате электролиза получается три важных промышленных
продукта – хлор, водород и щелочь. Для осуществления этого процесса
используют различные модификации электролизеров. Хлор получается и как
побочный продукт при электролитическом производстве магния из MgCl2.
Б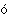 льшая
часть хлора используется для синтеза HCl по реакции с природным газом,
а HCl расходуется для получения MgCl2
из MgO. Хлор образуется
и в металлургии натрия из NaCl, однако метод электролиза из рассола дешевле.
В лабораториях промышленно развитых стран производят многие тысячи тонн
хлора по реакции 4HCl + MnO2
= MnCl2
+ 2H2O
+ Cl2. льшая
часть хлора используется для синтеза HCl по реакции с природным газом,
а HCl расходуется для получения MgCl2
из MgO. Хлор образуется
и в металлургии натрия из NaCl, однако метод электролиза из рассола дешевле.
В лабораториях промышленно развитых стран производят многие тысячи тонн
хлора по реакции 4HCl + MnO2
= MnCl2
+ 2H2O
+ Cl2.
Бром
получают
из скважин с рассолом, которые содержат больше бромид-ионов, чем морская
вода, являющаяся вторым по значимости источником брома. Бромид-ион легче
превращается в бром, чем фторид- и хлорид-ионы в аналогичных реакциях.
Поэтому для получения брома используют, в частности, хлор в качестве окислителя,
так как активность галогенов в группе убывает сверху вниз и каждый ранее
стоящий галоген вытесняет последующий. В производстве брома рассолы или
морскую воду предварительно подкисляют серной кислотой, а затем обрабатывают
хлором по реакции
2Br–
+ Cl2
® Br2
+ 2Cl–
Бром
выделяют из раствора выпариванием или продувкой с последующим его поглощением
разными реагентами в зависимости от дальнейшего применения. Например,
при реакции с нагретым раствором карбоната натрия получают кристаллические
NaBr и NaBrO3;
при подкислении смеси кристаллов бром регенерируется, обеспечивая не прямой,
но удобный метод накопления (хранения) этой коррозионно-активной с неприятным
запахом ядовитой жидкости. Бром можно также поглощать раствором SO2,
в котором образуется HBr. Из этого раствора бром легко выделить, пропуская
хлор (например, с целью проведения реакции брома с этиленом C2H4
для получения дибромэтилена C2H4Br2,
который используется как антидетонатор бензинов). Мировое производство
брома составляет свыше 300 000 т/год.
Иод
получают
из золы морских водорослей, обрабатывая ее смесью MnO2
+ H2SO4,
и очищают возгонкой. Иодиды в значительных количествах содержатся в подземных
буровых водах. Иод получают окислением иодид-иона (например, нитрит-ионом
NO2–
или хлором). Иод можно также осаждать в виде AgI,
из которого серебро регенерируют взаимодействием с железом, при этом образуется
FeI2.
Из FeI2
иод вытесняют хлором. Чилийская селитра, в которой содержится примесь
NaIO3,
перерабатывают для получения иода. Иодид-ион – важный компонент
пищи человека, так как он необходим для образования иодсодержащего гормона
тироксина, контролирующего рост и другие функции организма.
Реакционная
способность и соединения.
Все галогены реагируют
с металлами непосредственно, образуя соли, ионный характер которых зависит
и от галогена, и от металла. Так, фториды металлов, особенно металлов
подгрупп IA и IIA, являются ионными соединениями. Степень ионности связи
убывает с увеличением атомной массы галогена и уменьшением реакционной
способности металла. Галогениды с ионным типом связи кристаллизуются в
трехмерных кристаллических решетках. Например, NaCl (столовая соль) имеет
кубическую решетку. С увеличением ковалентности связи возрастает доля
слоистых структур (как у CdCl2,
CuCl2,
CuBr2,
PbCl2,
PdCl2,
FeCl2
и др.). В газообразном состоянии ковалентные галогениды часто образуют
димеры, например Al2Cl6
(димер AlCl3).
С неметаллами галогены образуют соединения с почти чисто ковалентной связью,
например галогениды углерода, фосфора и серы (CCl4
и др.). Максимальные степени окисления неметаллы и металлы проявляют в
реакциях со фтором, например SF6,
PF5,
CuF3,
CoF3.
Попытки получить иодиды аналогичного состава не удаются из-за большого
атомного радиуса иода (стерический фактор) и из-за сильной тенденции элементов
в высокой степени окисления к окислению I–
до I2.
Кроме прямого синтеза галогениды можно получать и другими методами. Оксиды
металлов в присутствии углерода реагируют с галогенами с образованием
галогенидов (например, Cr2O3
превращается в CrCl3).
Из CrCl3Ч6H2O
дегидратацией нельзя получить CrCl3,
а лишь основной хлорид (или гидроксохлорид). Галогениды получаются также
при обработке оксидов парами HX, например:

Хорошим
хлорирующим агентом является CCl4,
например для превращения BeO в BeCl2.
Для фторирования хлоридов часто применяют SbF3
(см. выше
SO2ClF).
Полигалогениды.
Галогены
реагируют со многими галогенидами металлов с образованием полигалогенидов
– соединений, содержащих крупные анионные частицы Xn–1.
Например:

Первая
реакция дает удобный метод получения высококонцентрированного раствора
I2
путем добавления иода к концентрированному раствору KI. Полииодиды сохраняют
свойства I2.
Возможно также получение смешанных полигалогенидов:
RbI
+ Br2
® RbIBr2
RbIСl2
+ Cl2
® RbICl4
Растворимость.
Галогены
обладают некоторой растворимостью в воде, однако, как и следовало ожидать,
из-за ковалентного характера связи X–X
и малого заряда растворимость их невелика. Фтор настолько активен, что
оттягивает электронную пару от кислорода воды, при этом выделяется свободный
O2
и образуются OF2
и HF. Хлор менее активен, но в реакции с водой получается некоторое количество
HOCl и HCl. Гидраты хлора (например, Cl2Ч8H2O)
могут быть выделены из раствора при охлаждении.
Иод проявляет необычные свойства при
растворении в различных растворителях. При растворении небольших количеств
иода в воде, спиртах, кетонах и других кислородсодержащих растворителях
образуется раствор коричневого цвета (1%-ный раствор I2
в спирте – обычный медицинский антисептик). Раствор иода в CCl4
или других бескислородных растворителях имеет фиолетовую окраску. Можно
полагать, что в таком растворителе молекулы иода ведут себя подобно их
состоянию в газовой фазе, которая имеет такую же окраску. В кислородсодержащих
растворителях происходит оттягивание электронной пары кислорода на валентные
орбитали иода.
Оксиды.
Галогены образуют оксиды. Никакой систематической закономерности или периодичности
в свойствах этих оксидов не наблюдается. Сходство и различия, а также основные
способы получения оксидов галогенов указаны в табл. 8б.
Оксокислоты
галогенов.
При образовании оксокислот
более четко проявляется систематичность галогенов. Галогены образуют галогеноватистые
кислоты HOX, галогенистые кислоты HOXO, галогеноватые кислоты HOXO2
и галогеновые кислоты HOXO3,
где X – галоген. Но только хлор образует кислоты всех указанных
составов, а фтор вообще не образует оксокислот, бром не образует HBrO4.
Составы кислот и основные способы их получения указаны в табл. 8в.
|
Таблица 8б.
ОКСИДЫ ГАЛОГЕНОВ
|
|
Фтор
|
Хлор
|
Бром
|
Иод
|
|
OF2
(из H2O + F2
или NaOH + F2)
|
Cl2O
(из HgO + Cl2)
|
Br2O
(из Br2 + HgO)
|
–
|
|
O2F2
(из смеси O2
+ F2 в искровом разряде)
|
ClO2
(из Cl2+AgClO3;
разложение HClO3)
|
BrO2
(из Br2 + O2
в тлеющем разряде)
– очень нестабилен
|
(IO2)x
или, вероятно, (IO)(IO3)
|
| |
Cl2O6
(из ClO2 + O3)
|
Br3O8
(из Br2 + O3)
– очень нестабилен
|
I2O5
(разложение HIO3)
|
| |
|
|
I4O9
(из O3 + I2)
|
|
Таблица 8в.
ОКСОКИСЛОТЫ ГАЛОГЕНОВ
|
|
Хлор
|
Бром
|
Иод
|
| HOCl –
хлорноватистая (из Cl2+H2O или
Cl2O + H2O);
соли – гипохлориты |
HOBr –
бромноватистая (из Br2 + H2O) |
HOI – иодноватистая
(из I2 + H2O или
I2+ HgO + H2O) |
| HOClO –
хлористая (из ClO2 + H2O); соли
– хлориты |
|
HOIO2 – иодноватая
(из I2+ Cl2 + H2O
или I2 + HNO3) |
| HOClO2 – хлорноватая
(из HOCl + H2O, тепло);
соли – хлораты |
HOBrO2 – бромноватая
(из Br2 + Cl2 + H2O) |
H5IO6 – параиодная
(из Cl2 + IO3– в
основной среде с последующим добавлением H2SO4).
Соли – Na2H3IO6, Ag5IO6 |
| HOClO3 – хлорная
(из H2SO4+KOClO3
или элек-тролитическое окисление KClO3 с
последующим подкислением); соли – перхлораты |
|
HIO4 – иодная
(при термической обработке H5IO6) |
Все
кислоты галогенов неустойчивы, однако чистая HOClO3
наиболее стабильна (в отсутствие любых восстановителей). Все оксокислоты
являются сильными окислителями, но скорость окисления необязательно зависит
от степени окисления галогена. Так, HOCl (ClI)
– быстрый и эффективный окислитель, а разбавленная HOClO3
(ClVII)
– нет. В целом, чем выше степень окисления галогена в оксокислоте,
тем сильнее кислота, поэтому HClO4
(ClVII)
– наиболее сильная из известных оксокислот в водном растворе. Ион
ClO4–,
образующийся при диссоциации кислоты в воде, – наиболее слабый из
отрицательных ионов донор электронной пары. Гипохлориты Na и Ca находят
промышленное применение при отбеливании и водоочистке.
Межгалогенные
соединения
– соединения
различных галогенов друг с другом. Галоген с б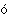 льшим
радиусом всегда имеет в таком соединении положительную степень окисления
(подвергается окислению), а с меньшим радиусом – более отрицательную
(подвергается восстановлению). Этот факт вытекает из общей тенденции изменения
активности в ряду галогенов. В табл. 8г приведены составы известных межгалогенных
соединений (А – галоген с более положительной степенью окисления). льшим
радиусом всегда имеет в таком соединении положительную степень окисления
(подвергается окислению), а с меньшим радиусом – более отрицательную
(подвергается восстановлению). Этот факт вытекает из общей тенденции изменения
активности в ряду галогенов. В табл. 8г приведены составы известных межгалогенных
соединений (А – галоген с более положительной степенью окисления).
|
Таблица 8г.
МЕЖГАЛОГЕННЫЕ СОЕДИНЕНИЯ
|
| АВ |
АВ3
|
АВ5
|
АВ7
|
| ClF |
ClF3
|
BrF5
|
IF7
|
| BrF |
BrF3
|
IF5
|
|
| ICl |
ICl3
|
|
|
| IBr |
|
|
|
Межгалогенные
соединения образуются прямым синтезом из элементов. Необычная для иода
степень окисления 7 реализуется в соединении IF7,
а другие галогены не могут координировать 7 атомов фтора. Прикладное значение
имеют BrF3
и ClF3
– жидкие вещества, химически аналогичные фтору, но более удобные
при фторировании. При этом более эффективен BrF3.
Поскольку трифториды – сильные
окислители и находятся в жидком состоянии, их используют как окислители
ракетного топлива.
Водородные
соединения.
Галогены реагируют
с водородом, образуя HX, причем со фтором и хлором реакция протекает со
взрывом при небольшой активации ее. Медленнее идет взаимодействие c Br2
и I2.
Для протекания реакции с водородом достаточно активировать небольшую долю
реагентов с помощью освещения или нагревания. Активированные частицы взаимодействуют
с неактивированными, образуя HX и новые активированные частицы, которые
продолжают процесс, а реакция двух активированных частиц по главной реакции
заканчивается образованием продукта. Например, образование HCl из H2
и Cl2:

Более
удобные методы получения галоиодоводородов, чем прямой синтез, дают, например,
следующие реакции:

В
газообразном состоянии HX являются ковалентными соединениями, однако в
водном растворе они (за исключением HF) становятся сильными кислотами.
Объясняется это тем, что молекулы воды эффективно оттягивают водород от
галогена. Все кислоты хорошо растворимы в воде благодаря гидратации:
HX
+ H2O
® H3O+
+ X–
HF
более склонен к комплексообразованию, чем другие галогеноводороды. Заряды
на H и F так велики, а эти атомы так малы, что происходит образование
HX-ассоциатов
типа полимеров состава (HF)x,
где x
і 3.
В таком растворе диссоциация под действием молекулы воды идет не более
чем на несколько процентов от общего количества ионов водорода. В отличие
от других галогеноводородов фтороводород активно реагирует с SiO2
и силикатами, выделяя газообразный
SiF4.
Поэтому водный раствор HF (плавиковая кислота) используют в травлении
стекла и хранят не в стеклянной, а в парафиновой или полиэтиленовой посуде.
Чистый HF кипит чуть ниже комнатной температуры (19,52°
С), поэтому его хранят в виде жидкости в стальных цилиндрах. Водный раствор
HCl называют соляной кислотой. Насыщенный раствор, содержащий 36% (масс.)
HCl, широко используют в химической промышленности и лабораториях
(см. также
ВОДОРОД).
Астат.
Этот
химический элемент семейства галогенов имеет символ At и атомный номер
85, он существует только в следовых количествах в некоторых минералах.
Еще в 1869 Д.И.Менделеев предсказал его существование и возможность открытия
в будущем. Астат был открыт Д.Корсоном, К.Маккензи и Э.Сегре в 1940. Известно
более 20 изотопов, из которых наиболее долгоживущие 210At
и 211At.
По некоторым данным, при бомбардировке 20983Bi
ядрами гелия образуется изотоп астат-211; сообщалось, что астат растворим
в ковалентных растворителях, может образовывать At–,
как и другие галогены, и, вероятно, возможно получение иона AtO4–.
(Эти данные удалось получить на растворах с концентрацией 10–10
моль/л.)
ПЕРЕХОДНЫЕ ЭЛЕМЕНТЫ
В
соответствии с периодической классификацией элементов существует 44 элемента,
образующих подгруппы А. В каждой из этих подгрупп (или семейств) на внешней
(валентной) электронной оболочке число электронов равно номеру группы.
При переходе от элемента одной подгруппы к элементу соседней подгруппы
вдоль периода слева направо число валентных электронов возрастает на 1.
Поэтому происходит регулярное изменение свойств от металлических в семействах
с низкими номерами до неметаллических в семействах с б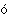 льшими
номерами. В то же время имеется более 60 элементов, которые не подчиняются
вышеописанным принципам застройки электронной структуры. Все эти элементы
являются металлами по своим химическим свойствам (некоторые – очень
активными), сходными с металлами подгруппы IIA. В этом классе находятся
металлы, образующие сплавы (Fe, Mn, Mo, Cu, Zn, Pt, Au и др.) либо являющиеся
драгоценными металлами, обладающие важными структурными свойствами. У
этих элементов в отличие от элементов подгрупп А, у которых заполняется
электронами внешний слой, электроны поступают на внутренние слои, а элементы
называются «переходными». льшими
номерами. В то же время имеется более 60 элементов, которые не подчиняются
вышеописанным принципам застройки электронной структуры. Все эти элементы
являются металлами по своим химическим свойствам (некоторые – очень
активными), сходными с металлами подгруппы IIA. В этом классе находятся
металлы, образующие сплавы (Fe, Mn, Mo, Cu, Zn, Pt, Au и др.) либо являющиеся
драгоценными металлами, обладающие важными структурными свойствами. У
этих элементов в отличие от элементов подгрупп А, у которых заполняется
электронами внешний слой, электроны поступают на внутренние слои, а элементы
называются «переходными».
За некоторыми исключениями, в целом
для электронного строения переходных элементов характерно наличие двух
электронов на внешней электронной оболочке, т.е. на ns-уровне,
и размещение следующих электронов на внутреннюю оболочку, т.е. на уровень
(n –
1) или (n
– 2). Так как химические и многие физические свойства определяются
типом и энергией внешних электронов по отношению к ядру, а структуры внешних
электронных оболочек идентичны для всех переходных элементов, то и наблюдается
много сходства в их химических и физических свойствах. Добавление к каждому
последующему (в ряду периодической таблицы) металлу одного протона к ядру
и одного электрона на внутреннюю оболочку не увеличивает радиуса, а скорее
несколько уменьшает его. Это уменьшение, или сжатие, несопоставимо по
величине с сжатием в горизонтальном ряду непереходных элементов периодической
таблицы (например, от Li до F), но имеет ту же природу.
Переходные элементы можно разделить
на две отдельные группы серий в зависимости от того, расположены последующие
электроны на первом (n
– 1)
или втором (n
– 2)
уровне от внешнего слоя. Соответственно элементы относятся в первом случае
к коротким (1-му и 2-му) переходным рядам и нормальным сериям (d-сериям)
длинных (3-го и 4-го) переходных рядов, а во втором случае – к внутренним
сериям (f-сериям)
длинных переходных рядов (см.
табл. 9).
|
Таблица 9. ПЕРЕХОДНЫЕ
ЭЛЕМЕНТЫ
|
| Ряды
и серии переходных элементов |
Энергетический
уровень
|
Элементы
|
Орбиталь
|
| 1-й ряд
(короткий) |
n – 1
|
21Sc – 30Zn
|
3d
|
| 2-й ряд
(короткий) |
n – 1
|
39Y – 48Cd
|
4d
|
| 3-й ряд
(длинный) |
|
|
|
| внутренняя
серия |
n – 2
|
57La – 71Lu (лантаноиды)
|
4f
|
| нормальная
серия |
n – 1
|
72Hf – 80Hg
|
5d
|
| 4-й ряд
(длинный) |
|
|
|
| внутренняя
серия |
n – 2
|
89Ac – 103Lr (актиноиды)
|
5f
|
Не
всегда можно точно предсказать или рассчитать электронную конфигурацию
элементов с большими атомными номерами, поэтому некоторые обозначения
нельзя считать окончательными. Среди химиков нет полного согласия об обозначении
элементов подгрупп IB и IIB как подгрупп переходных элементов. В частности
это относится к металлам Cu, Ag, Au (IB) и Zn, Cd, Hg (IIB). В каждой
из этих подгрупп элементы содержат внутреннюю завершенную оболочку из
18 электронов. Поэтому если определение переходного элемента предусматривает
расположение очередного электрона во внутренней оболочке, то металлы подгрупп
IB и IIB не являются ни переходными, ни непереходными элементами. Но поскольку
они обладают многими свойствами, общими со свойствами переходных элементов,
то их в этом разделе относят к переходным элементам.
Общие
свойства.
Сначала рассматриваются
некоторые общие свойства, затем свойства по подгруппам и отдельные элементы
более детально. Общие и физические свойства сведены в таблицы.
Электронная
конфигурация.
За некоторым исключением
все переходные элементы имеют 2 электрона на внешнем или высшем энергетическом
уровне и один или более электронов на низшем (n
– 1) или (n
– 2). При переходе от элемента к элементу в пределах одного ряда
элементов ядро увеличивается на 1 протон, увеличивая заряд, и соответственно
число электронов также увеличивается на 1. Этот дополнительный электрон
располагается на (n
– 1) или (n
– 2) уровне, т.е. на внутренней оболочке, что приводит к некоторому
уменьшению радиуса атома, или сжатию с увеличением атомного номера. На
основании этого эффекта можно объяснить многие периодические изменения
свойств.
Образование
связи.
Описанное электронное
строение позволяет всем этим элементам образовывать химическую связь в
соединениях с участием 3 электронов; многие переходные элементы образуют
связь с помощью 2 внешних электронов, и все эти элементы могут (хотя и
не всегда) предоставлять количество электронов, равное номеру группы,
в которой находится данный элемент. Возможность участия в связеобразовании
различного числа электронов называется поливалентностью. Например, у марганца,
элемента подгруппы VIIВ, степень окисления изменяется от II (MnCl2)
до VII (KMnO4).
Чем больше электронов участвует в образовании химической связи, тем более
ковалентной становится связь.
Окраска
ионов.
Так как при переходе
от одного элемента к другому вдоль ряда переходных элементов в периодической
таблице последующие электроны поступают на внутреннюю оболочку и поэтому
мало энергетически отличаются друг от друга, то достаточно небольших затрат
энергии для перескока электрона в более высокое энергетическое состояние.
Атомы и ионы, которые имеют такие подвижные электроны, обычно хорошо окрашены,
так как энергии света достаточно для перескока электронов. Поэтому многие
ионы переходных элементов окрашены и образуют окрашенные соединения.
Физические
свойства.
Малое количество электронов
на внешнем уровне объясняет высокую электро- и теплопроводность переходных
металлов. Те же электроны могут участвовать и в образовании связей между
атомами одного элемента. Природа такого связеобразовании не всегда понятна,
но коррелирует с высокими величинами температур плавления и кипения. Строгой
тенденции внутри семейства переходных металлов не существует, но атом
третьего члена подгруппы В не должен быть больше атома стоящего над ним
металла. Например, атомный радиус Zr равен 1,57  ,
а третий член подгруппы IVB
– Hf, стоящий под Zr, также имеет r
= 1,57 ,
а третий член подгруппы IVB
– Hf, стоящий под Zr, также имеет r
= 1,57  . .
Магнитные
свойства.
Общее правило застройки
электронных оболочек атомов состоит в том, что электроны заполняют незанятые
орбитали неспаренными электронами, прежде чем начнется заселение орбиталей
вторым электроном с образованием пары электронов с одинаковой энергией.
Для всех переходных элементов (кроме свободных металлов подгрупп IB и
IIB) внутренний уровень (n
– 1 или n
– 2) будет иметь такие неспаренные электроны. Благодаря этим электронам
атом или ион «втягивается» электромагнитным полем, т.е. обладает парамагнетизмом.
Атом или ион, имеющий спаренные электроны, «выталкивается» электромагнитным
полем, и такое свойство называется диамагнетизмом.
У некоторых переходных металлов, например у Fe из подгруппы VIIIВ, парамагнетизм
выражен очень сильно и его принято называть ферромагнетизмом.
Образование
комплексных ионов.
Малый радиус переходного
элемента и наличие вакантных орбиталей для размещения электронов являются
благоприятными условиями для взаимодействия этих элементов с большим количеством
молекул и ионов, способных быть донорами электронов. Образующиеся по такому
механизму соединения или ионы называются координационными или комплексными.
Более детальное обсуждение переходных элементов приведено при рассмотрении
каждой подгруппы. Порядок их рассмотрения основан на общем правиле классификации
элементов, начиная с подгруппы IIIB, а подгруппы IB и IIB рассматриваются
в конце как последние члены 1-го, 2-го и 3-го рядов переходных металлов.
Последняя, внутренняя серия 4-го ряда переходных металлов – актиноиды
или трансурановые элементы – рассматривается отдельно.
ПОДГРУППА IIIB. РЕДКОЗЕМЕЛЬНЫЕ ЭЛЕМЕНТЫ
(РЗЭ)
СКАНДИЙ, ИТТРИЙ И ЛАНТАНОИДЫ
Скандий
Sc обычно химически объединяется
в одной подгруппе с серией лантаноидов (атомные номера 57–71), хотя
по электронной конфигурации отличается от них: его дополнительный (в сравнении
с предшественником – кальцием) электрон находится на уровне (n
– 1), а не на (n
– 2). (По этой причине скандий, а иногда и иттрий обычно рассматривают
отдельно, а остальные члены этой подгруппы относят к редкоземельным элементам.)
Скандий встречается в незначительном количестве в минералах, содержащих
редкоземельные элементы (например, монацит, гадолинит и др.). Наиболее
распространенным источником скандия является минерал тортвейтит ScSi2O7.
Для отделения элемента руду сначала смешивают с концентрированной серной
кислотой или сплавляют с гидросульфатом калия. После обработки водой удаляются
растворимые сульфаты. Нежелательные тяжелые металлы удаляют осаждением
в виде сульфидов или тщательной обработкой щелочным раствором. Все РЗЭ,
включая скандий, осаждают щавелевой кислотой. Затем скандий отделяют от
других металлов в виде сульфата Sc2(SO4)3Ч5H2O,
который более растворим, чем сульфаты других редкоземельных элементов.
Металлический скандий получают электролизом из расплава его хлорида на
цинковом катоде. Металлический цинк отделяют от отложившегося на нем скандия
отгонкой. Скандий отличается от других элементов семейства IIIB образованием
менее основного оксида, хотя еще и не амфотерного. В ряду РЗЭ хлорид скандия
более летуч, а нитрат менее термически устойчив. Комплексные соединения
скандия несколько более устойчивы, и удивительно, что скандий образует
нормальный карбонат несмотря на маленький радиус и высокую зарядовую плотность
иона Sc3+.
Иттрий
Y более сходен с лантаноидами,
чем скандий, несмотря на то, что не имеет 4f-электронов,
как лантаноиды. Когда руду, содержащую РЗЭ, обрабатывают серной кислотой
или сплавляют с KHSO4
и сульфаты подвергают фракционной кристаллизации, иттрий оказывается в
группе более растворимых сульфатов Dy, Ho, Er, Tm, Yb и Lu (тяжелые лантаноиды).
Отделение иона Y3+
с высокой чистотой от других «редких земель» достигается экономически
эффективными методами ионного обмена или жидкостной экстракции.
Гидроксиды и оксиды иттрия несколько
сильнее и лучше растворимы, чем аналогичные соединения тербия, но слабее
соответствующих гидроксидов лантана. Соединения иттрия по свойствам ближе
к соединениям конца ряда лантаноидов (Gd
– Lu).
Лантаноиды.
Элементы с атомными номерами
57–71 составляют серию лантаноидов (Ln)
и занимают одну клетку в периодической таблице, что подчеркивает их химическое
сходство. (В тех случаях, когда скандий и иттрий не рассматривают как
РЗЭ, понятие редкоземельных элементов распространяется только на лантаноиды
с атомными номерами 57–71.) Но часто лантан (элемент-57) рассматривают
отдельно от лантаноидов, относя к последним только элементы с атомными
номерами 58–71, так как по электронному строению лантан отличается
от лантаноидов (внутренняя серия 3-го, длинного ряда переходных металлов),
поскольку не имеет f-электронов.
Электрон, отличающий его от предшествующего элемента – бария, находится
на 5d-орбитали.
В то же время по свойствам он очень близок к лантаноидам 58–71.
Эти элементы, хотя и не отличаются крупными месторождениями, не являются
редкими и достаточно широко рассеяны в природе. Термин «редкие» более
относится к их необычным свойствам, чем к распространению. Их содержание
в земной коре колеблется от 0,7 млн.–1
для лютеция Lu до
44 млн.–1
для церия Ce.
Лантаноиды
группируют по растворимости их сульфатов или по небольшому различию их
основных свойств. В результате лантаноидного сжатия по ряду элементов
сходство в электронном строении определяет и сходство в химических свойствах.
Ионы Ln3+
образуют особенно близкие по растворимости соли и сходные по основности
и комплексообразованию соединения. Последнее свойство и некоторое различие
внутри семейства определяют метод разделения.
До середины 1940-х годов разделение
лантаноидов достигалось в основном многостадийной процедурой фракционной
перегонки двойных сульфатов, оксалатов и нитратов. Так как ионы лантаноидов
очень мало различаются в размерах (радиусах), то и различие в растворимости
таких соединений очень мало. Необходимы тысячи процедур даже для грубого
разделения. Научный и практический интерес к отдельным членам семейства
привел к созданию для них более эффективных методов разделения.
Химические
свойства. Все
лантаноиды (Ln)
образуют общие типы соединений, поэтому необязательно рассматривать каждый
элемент в отдельности. Все они достаточно химически активны, в чем близки
к щелочноземельным и даже к легким щелочным металлам (см. табл. 10, электродные
потенциалы). Металлы активно реагируют с кислотами и даже из воды выделяют
водород и образуют в воде растворы основного характера. При горении в
кислороде они образуют оксиды состава Ln2O3.
С галогенами образуют тригалогениды, с серой – сульфиды типа Ln2S3,
с водородом – гидриды (в основном металлической природы). Ионы Ln3+
при реакции со слабыми и сильными основаниями образуют, подобно алюминию,
гелеобразные гидроксиды Ln(OH)3,
но, в отличие от гидроксида алюминия, нерастворимые в избытке щелочи.
Лантаноиды образуют много двойных солей, например, 2LnIII(NO3)3Ч3Mg(NO3)2Ч2H2O
и Ln2III(SO4)3Ч3Na2SO4ЧxH2O.
Таблица
10. РЕДКОЗЕМЕЛЬНЫЕ ЭЛЕМЕНТЫ
Способность
ионов лантаноидов к комплексообразованию проявляется при наличии у лигандов
электронных пар. Азот- и кислородсодержащие молекулы типа аминов и органических
кислот образуют комплексы с лантаноидами. Устойчивость этих комплексных
соединений лантаноидов в сравнении с их аналогами для металлов из коротких
рядов переходных несколько ниже.
Лантаноиды входят в состав сплавов с
высокой искрящей способностью, используемых в производстве кремней для
зажигалок. Смешанные оксиды лантаноидов, например с ThO2,
применяют в производстве сеток накаливания для газоразрядных осветительных
устройств. Соли лантаноидов используют для окрашивания или обесцвечивания
стеклоизделий. Оксиды лантаноидов применяют также для полирования линз,
зеркал и изготовления искусственных драгоценных камней.
ПОДГРУППА IVB. СЕМЕЙСТВО ТИТАНА
ТИТАН, ЦИРКОНИЙ, ГАФНИЙ
К
переходным металлам относятся также
элементы семейства титана – Ti, Zr и Hf, отличающиеся удивительным
сходством свойств. Последние два элемента (Zr и Hf) особенно близки по
свойствам. Действительно, Hf был открыт благодаря рентгенографическому
изучению цирконических материалов. Hf был первым элементом, открытым методом
рентгенографии, и открыт он был спустя 140 лет после открытия циркония.
Поэтому все значения атомной массы циркония, определенные до 1923, оказались
неточны, так как Zr фактически всегда содержит некоторое количество гафния.
Близкие к ковалентным атомные радиусы Zr и Hf, а также сходная внешняя
электронная конфигурация d2s2
делают понятным большое сходство химических и многих физических свойств.
Появление у гафния 32 протонов и около 50 нейтронов (в зависимости от
изотопного состава) в том же объеме, что и у Zr, приводит к значительно
большей плотности Hf по сравнению с его предшественником (см.
табл. 11).
Все три элемента подгруппы относятся
к истинным металлам, проявляют хорошую электропроводность, обладают положительным
электродным потенциалом, образуют типичные соли. Металличность в подгруппе
несколько возрастает от титана к гафнию. Все эти металлы имеют стабильную
степень окисления IV, тем не менее химическая связь в их галогенидах и
некоторых других солях типично ковалентная. Они могут проявлять также
степень окисления II и III, но из этих состояний легко окисляются до степени
окисления IV.
Таблица
11. ТИТАН, ЦИРКОНИЙ, ГАФНИЙ
Титан.
Титан
– девятый по распространенности элемент земной коры. Его руды очень
устойчивы к обычным реагентам. Развитие металлургии титана объясняется
обнаружением у него полезных свойств – способностью образовывать
коррозионностойкие и термостойкие сплавы. Обычные восстановители, такие,
как кокс и уголь, непригодны для выделения титана из его оксида TiO2,
так как при этом образуются очень тугоплавкие и твердые карбиды титана
типа TiC. Процесс получения титана заключается в пропускании газообразного
Cl2
над TiO2
или FeTiO3
в присутствии углерода. Образующийся при этом летучий тетрахлорид титана
TiCl4
выделяется из системы, а затем его конденсируют в жидкость (т. кип. 136°
С) и очищают с помощью перегонки. Восстановление тетрахлорида до металла
проводят магнием при 750–900°
С в инертной среде благородного газа, например аргона. Эффективным восстановителем
является также натрий. Образующийся губчатый металлический титан необходимо
спекать или нагревать до высоких температур для получения пластичного
массивного слитка. Чистый пластичный металл получается и при восстановлении
тетраиодида в водородной среде на нагретой вольфрамовой нити. Для производства
титановых сталей используют титан, полученный восстановлением FeTiO3
углеродом. Обычно металл получают в виде ферротитанового сплава, который
добавляют в расплав стали без дополнительной очистки. Добавки титана в
сталь увеличивают ее прочность и ударную стойкость. Небольшая плотность
титана, коррозионная стойкость и низкий коэффициент теплового расширения
позволяют использовать эти сплавы в авиационной и ракетной технике. Проблемой
для широкого применения является быстрое уменьшение прочности титановой
стали при нагревании. Кроме того, при нагревании на поверхности сплава
образуются оксиды и нитриды, что увеличивает ломкость. Карбиды, нитриды
и бориды титана очень тугоплавки и тверды, поэтому их применяют в технологии
режущего и сверлильного инструмента.
См. также
МЕТАЛЛЫ ЧЕРНЫЕ;
СПЛАВЫ;
АВИАЦИОННО-КОСМИЧЕСКИЕ КОНСТРУКЦИИ.
Цирконий
и гафний.
Руды циркония и гафния
представляют собой силикаты и оксиды. Методы извлечения и выделения циркония
и гафния довольно близки к методам, применяемым в металлургии титана.
Чистый цирконий применяется в атомной энергетике, так как имеет очень
низкое сечение захвата и поглощения нейтронов, а также высокую термо-
и коррозионную стойкость. Добавки циркония улучшают свойства хромовых
сталей. Применение гафния в промышленности осложняется трудностью его
отделения от циркония и малой распространенностью в природе. Разделение
гафния и циркония основано на небольшом различии в растворимости фторокомплексов
ZrF62–
и HfF62–.
Разделение металлов возможно также методами ионного обмена и экстракции
комплексных соединений.
Химические
свойства.
Существует некоторое
различие в химических свойствах титана, с одной стороны, и циркония и
гафния, с другой. Все металлы IVB подгруппы реагируют при нагревании с
кислородом, образуя MO2.
Диоксид титана TiO2
существует в природе в виде минерала рутила – темнокоричневого вещества
с примесями. TiO2
в промышленности получают по реакции TiCl4
со щелочью с последующим прокаливанием для удаления воды; получаемый таким
способом TiO2
представляет собой белое инертное вещество, широко применяемое как пигмент;
оно не ядовито и благодаря прочной адгезии используется в промышленности
красок.
При гидролизе TiCl4
образуется не истинный гидроксид Ti(OH)4,
а гидратированный оксид, который существует в двух формах, a
и b.
При испарении или распылении TiCl4
во влажной среде получают дымовые завесы. При высокой температуре TiO2
переходит в оксид титана(III) Ti2O3.
Монооксид TiO получается при прокаливании смеси Ti + TiO2.
При сплавлении TiIVO2
с основаниями, например, NaOH
или Na2CO3,
получается титанат натрия Na2TiIVO3,
что свидетельствует об амфотерности TiO2.
Титан проявляет несколько более слабые металлические свойства, чем цирконий,
так как TiCl4
почти не подвергается гидролизу, образуя TiOCl2.
Более тяжелые металлы подгруппы легко образуют ионы MO22+.
Zr
и Hf тоже образуют диоксиды ZrO2
и HfO2,
а также полуторные оксиды Zr2O3
и Hf2O3
и монооксиды ZrO и HfO. Однако только образование диоксидов является общим
для всей подгруппы. Гидроксиды Zr(OH)4
и Hf(OH)4,
очевидно, не существуют, но при взаимодействии ионов этих металлов со
щелочами образуются гидратированные оксиды. Образование гидроксидов с
низшими степенями окисления металлов не установлено. Активность металлов
по отношению к кислороду, кислотам и основаниям сильно зависит от чистоты
металла. При действии сильных оснований на диоксиды образуются цирконаты
MZrO3
и гафнаты MHfO3.
Галогениды.
Большинство
галогенидов всех трех элементов известно для всех степеней окисления металлов.
Например, тетрахлорид титана TiCl4
получается в виде бесцветного газа при обработке TiO2
хлором при повышенных температурах в присутствии углерода. При конденсации
образуется жидкость. TiCl4
похож на SiCl4,
но имеет более высокую температуру кипения, что объясняется различием
в строении молекул (у SiCl4
тетраэдрическая, а у TiCl4
искаженная структура). При восстановлении TiCl4
металлическим натрием получается TiCl2.
Трихлорид титана TiCl3
образуется при восстановлении TiCl4
водородом. Хлориды, бромиды и иодиды всех трех металлов в низших степенях
окисления интенсивно окрашены и неустойчивы. Соли Ti(III) находят применение
в аналитической химии как восстановители. Тетрагалогениды легко принимают
два галогенид-иона, образуя комплексные ионы:
TiCl4
+ 2Cl–
 [TiCl6]2–
[TiCl6]2–
Тетрафторид
титана образуется при обработке TiCl4
парами фтороводорода HF:
TiCl4
+ 4HF  TiF4
+ 4HCl
TiF4
+ 4HCl
Среди
других галогенидов известны TiI2
, TiI3,
TiI4,
ZrI4.
Сульфиды.
При
обработке TiCl4
сероводородом на холоду образуются TiS и сера, а при нагревании
TiS2.
Последний восстанавливается водородом до Ti2S3,
а при действии HNO3
на TiS2
образуются соединение Ti(IV) и
элементная сера. Цирконий и гафний также образуют моносульфиды и дисульфиды.
Комплексообразование.
Увеличение
металлического характера тяжелых
членов семейства проявляется в образовании цирконил- и гафнил-ионов при
гидролизе солей М(IV) в воде. Такое химическое сродство маленьких по размеру
с большим положительным зарядом ионов способствует образованию многочисленных
комплексных соединений с органическими оксосоединениями. Особенно устойчивы
дикетонатные комплексы Zr(IV) и Hf(IV). Сильное комплексообразующее действие
проявляется в образовании галогенидных комплексных ионов типа [HfF7]3–
с необычно большим и редким координационным
числом 7.
ПОДГРУППА VB. СЕМЕЙСТВО ВАНАДИЯ
ВАНАДИЙ, НИОБИЙ, ТАНТАЛ
Различие в химических и физических свойствах
среди членов этого семейства переходных металлов – ванадия V, ниобия
Nb и тантала Ta – несколько больше, чем отмеченное у элементов подгруппы
IVB. Например, более тяжелые элементы Nb и Ta имеют одинаковый радиус,
но последний элемент вдвое тяжелее (табл. 12), что приводит к резкому
увеличению плотности Ta по сравнению с Nb.
Все элементы подгрупп IVB и VB имеют высокие температуры плавления, что
свойственно элементам, расположенным в середине периодов. Ниобий отличается
необычностью электронного строения, так как имеет единственный электрон
на внешней s-орбитали
(4d45s1). Это можно объяснить
сильным взаимодействием положительного заряда ядра с 5s-электронами,
из-за чего один из них втягивается на 4d-орбиталь.
Однако химическое поведение ниобия в норме соответствует электронной конфигурации
4d35s2,
так что различие свойств Nb и Ta невелико. Между Nb и Ta больше сходства,
чем между V и Nb, что понятно при идентичности радиусов.
При обычной температуре все эти металлы
инертны, благодаря чему применяются в сплавах для производства специального
обрабатывающего инструмента и коррозионностойких емкостей. Все элементы
подгруппы проявляют максимальную степень окисления V. Соединения с низшими
степенями окисления (II и III) стабильнее у более легкого элемента ванадия,
чем у более тяжелых Nb и Ta. Соединения ванадия(II) – хорошие восстановители,
они даже выделяют водород из воды. Различие в окислительной способности
этих металлов проявляется в том, что сильные восстановители типа Zn и
HCl восстанавливают VV
до VII,
NbV
до NbIV,
но не действуют на TaV.
(Для элементов любого семейства, в котором существует поливалентность,
легкие члены семейства всегда имеют стабильные высокие степени окисления,
а тяжелые, как правило, легко переходят из состояния с высокой степенью
окисления в более стабильное состояние с низкой степенью окисления.)
Таблица
12. ВАНАДИЙ, НИОБИЙ, ТАНТАЛ
В
степени окисления V элементы обычно
образуют бесцветные соединения,
а в низших степенях окисления ионы и соединения сильно окрашены. Окраска
определяется подвижностью электронов нижних электронных слоев под действием
света. Ионы в одинаковом состоянии часто имеют одинаковую окраску.
Структура соединений, образованных V,
Nb и Ta, сильно зависит от степени окисления металла и типа электронных
оболочек, участвующих в образовании связи. При образовании комплексных
соединений металлы проявляют высокие координационные числа (число ассоциированных
у металла групп). Так, Ta образует необычные фторокомплексные ионы [TaF8]3–
и [TaF7]2–.
Выделение
из руд. Элементы
V, Nb и
Ta очень
трудно получить в чистом виде из их руд и непросто восстановить из ионных
состояний до свободного металла. Руду ванадинит Pb5(VO4)3Cl
обрабатывают HCl до образования нерастворимого PbCl2
и растворимого ванадил(V)-иона
VO2+.
При добавлении к раствору NH4Cl
выпадает осадок NH4VO3,
который при прокаливании образует V2O5
– исходное вещество для
получения металла и многих соединений ванадия. Металлический ванадий получают
восстановлением его
оксида алюминием. Свободный металл может быть получен также из подкисленных
хлороводородной кислотой растворов Na3VO4
или NaVO3
методом электролиза. Для использования в сплавах применяют неочищенный
феррованадий FeV, получающийся прокаливанием V2O5
с железным ломом. Феррованадий имеет более низкую температуру плавления,
чем чистый ванадий, и поэтому он предпочтительнее для легирования расплавов
стали.
См. также
МЕТАЛЛЫ ЧЕРНЫЕ;
СПЛАВЫ.
Ниобий и тантал выделяют из их руд
сплавлением с содой или KHSO4
с последующей экстракцией водой с образованием водорастворимой фазы. Разделение
двух химически сходных металлов может быть достигнуто обработкой раствора
KF, который эффективно осаждает K2(TaF7),
при этом б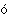 льшая
часть ниобия остается в растворе в виде K2(NbOF5).
Для разделения этих комплексов также применяется жидкостная экстракция. льшая
часть ниобия остается в растворе в виде K2(NbOF5).
Для разделения этих комплексов также применяется жидкостная экстракция.
Применение.
Металлический тантал
в отличие от ниобия находит разнообразное применение. Электролизом фторокомплекса
K2TaF7
получают свободный тантал. Благодаря химической инертности, высокой коррозионной
стойкости, а также хорошей теплопроводности его используют в производстве
хирургических шин, винтов, пластин, тонких сеток и др., предназначенных
для имплантации в живой организм. Трубы, приемники и другое химико-технологическое
оборудование часто изготовляют из тантала для работы с коррозионно-активными
парами и жидкостями. С помощью тантало-свинцово-сернокислотного выпрямителя
получают пульсирующий ток. Кроме того, тантал применяют как добавку к
стали и для получения сплава с вольфрамом, используемого в электровакуумной
технике. Карбид TaC – очень твердое вещество, используемое для изготовления
специальных сверл и других режущих инструментов. Ванадий применятся как
легирующий элемент в сталях.
Химические
свойства. При
низких температурах все эти металлы устойчивы к кислороду и большинству
реагентов. Это отчасти удивительно, так как все они имеют положительные
окислительные потенциалы. Однако на поверхности рассматриваемых металлов
легко образуется пассивирующая пленка, что повышает инертность и затрудняет
измерение потенциалов. Ванадий активнее ниобия и тантала. При нагревании
все эти металлы взаимодействуют с кислородом HNO3
и NaOH. При действии NaOH на ванадий образуется NaVO3
и выделяется водород.
Реакции.
Все члены этого семейства
образуют пентаоксиды, слаборастворимые в воде и дающие слабокислую реакцию.
Пентаоксид ванадия V2O5
наиболее важен как промышленный катализатор окисления SO2
в SO3
(контактный метод производства серной кислоты), окисления спиртов и гидрогенизации
масел в жиры:

Красно-оранжевый
оксид ванадия наиболее удобно получать термическим разложением ванадата
аммония NH4VO3:
2NH4VO3
® V2O5
+ 2NH3
+ H2O.
Амфотерный
характер ванадия проявляется при растворении V2O5
в NaOH с образованием ортованадата Na3VO4.
При добавлении NH4+
в раствор образуется метаванадат аммония NH4VO3,
что необычно, так как ион аммония, как правило, не является восстановителем.
При изменении кислотности ванадатных растворов протекают процессы конденсации
или полимеризации оксоанионов с образованием соединений, называемых изополисолями
и изополикислотами, например, [V3O8]–
– триполиванадат(V), [V4O9]2–
– тетраполиванадат(V), [V6O17]4–
– гексаполиванадат(V). Пентаоксиды Nb и Ta образуются при прямом
окислении. Они достаточно устойчивы к действию восстановителей (см.
выше). Пентаоксид ванадия
восстанавливается до VO2
при нагревании со щавелевой кислотой H2C2O4.
Монооксид углерода и водород восстанавливают V2O5
до V2O3
и даже до VO. Все эти оксиды окрашены.
Галогениды.
Все металлы подгруппы
VB
образуют пентагалогениды, но между ними существуют различия в свойствах.
Пентафторид ванадия VF5
(белого цвета) – единственный пентагалогенид ванадия, другие галогениды
ванадия(V)
неустойчивы из-за окислительной способности Vv.
В табл. 12а указано, из чего могут быть синтезированы некоторые галогениды
ванадия и ниобия.
|
Таблица 12а.
ИСХОДНЫЕ ВЕЩЕСТВА ДЛЯ ПОЛУЧЕНИЯ НЕКОТОРЫХ ГАЛОГЕНИДОВ ВАНАДИЯ И
НИОБИЯ
|
| Галогенид |
Получение
|
Галогенид
|
Получение
|
| VCl5 |
Из CCl4,
C, V2O5 |
VF5 |
Разложение
VF4 |
| VCl4 |
Из FeV
и Cl2 |
VF3 |
Разложение
VF4 |
| VCl4 |
Разложение
VCl3 |
NbCl5 |
Из Nb2S5
и Cl2 |
| VCl2 |
Разложение
VCl3 |
NbF5 |
Из NbCl5
и HF |
| VF3 |
Из VCl3
и HF |
NbBr5 |
Из Nb
и Br2 |
Галогениды
с низшей и высшей степенью окисления элемента образуются по реакциям диспропорционирования
из галогенидов с промежуточной степенью окисления металла. Способы получения
и свойства галогенидов тантала и ниобия аналогичны. Все галогениды подвергаются
гидролизу с образованием оксогалогенидов по схеме
VF5
+ H2O
= VOF3 +
2HF
При
взаимодействии оксидов, например V2O5,
с галогенами (Cl2
или Br2)
также образуются оксогалогениды (VOCl3
или VOBr3).
Cульфиды.
При взаимодействии V2O5
с CS2,
очевидно, получается только V2S3,
а не V2S5;
трисульфид образуется также при действии сухого H2S
на V2O3.
Дисульфид тантала TaS2
образуется из Ta2O5
и CS2.
VS образуется при гидрировании V2S3.
Нестехиометрические
гидриды. При
нагревании кусочков металла с водородом образуются гидриды нестехиометрического
состава; хотя при этом и выделяется тепло, но сомнительно, что образуются
истинные соединения. По результатам анализов отношение металл: водород
составляет примерно 1:0,8.
ПОДГРУППА VIB. СЕМЕЙСТВО ХРОМА
ХРОМ, МОЛИБДЕН, ВОЛЬФРАМ
Все
три элемента VIB подгруппы – хром Cr, молибден Mo, вольфрам W –
играют большую роль в промышленности, особенно в металлургии и электротехнике.
Каждый из этих элементов занимает среднее положение в своем ряду переходных
металлов. Элементы имеют, как и следовало ожидать, высокие температуры
плавления и кипения; наличие вакантных мест на электронных орбиталях допускает
обобществление электронов при образовании связей. Два из трех элементов
– хром и молибден – обладают нетипичной электронной структурой
(табл. 13), имея на внешней s-орбитали
один электрон (как у Nb из подгруппы VB).
Поскольку у этих элементов на внешних d-
и s-орбиталях
находится всего 6 электронов, все орбитали заполнены наполовину, т.е.
по 1 электрону на каждой. При такой электронной конфигурации элемент обладает
необычной стабильностью и устойчивостью к окислению. У вольфрама обычное
электронное строение, поэтому между молибденом и вольфрамом больше различий
в химических свойствах, чем между п рами
тяжелых элементов в предыдущих семействах (например, Zr и Hf, Nb и Ta).
У вольфрама более сильная металлическая связь, чем у молибдена. Все рассматриваемые
металлы покрываются пассивирующей оксидной пленкой при хранении на воздухе
или в среде кислоты-окислителя. При удалении этой пленки химическим или
механическим способом химическая активность металлов существенно возрастает
(см.
электродные потенциалы в табл. 13). Доказательством этого является выделение
водорода при обработке хрома хлороводородной кислотой или даже паром. рами
тяжелых элементов в предыдущих семействах (например, Zr и Hf, Nb и Ta).
У вольфрама более сильная металлическая связь, чем у молибдена. Все рассматриваемые
металлы покрываются пассивирующей оксидной пленкой при хранении на воздухе
или в среде кислоты-окислителя. При удалении этой пленки химическим или
механическим способом химическая активность металлов существенно возрастает
(см.
электродные потенциалы в табл. 13). Доказательством этого является выделение
водорода при обработке хрома хлороводородной кислотой или даже паром.
Таблица
13. ХРОМ, МОЛИБДЕН, ВОЛЬФРАМ
Степени окисления.
У
этих элементов обнаруживается интересное различие в степенях окисления.
В соответствующих условиях все элементы способны проявлять положительные
степени окисления от II до VI, хотя не все эти степени окисления одинаково
стабильны. Максимальная степень окисления VI соответствует номеру группы.
У хрома наиболее стабильной является степень окисления III, и только очень
сильные окислители окисляют Cr(III) в Cr(VI). В то же время даже слабые
окислители окисляют Mo(III) до степеней окисления IV и VI. Голубой ион
Cr(II) образуется в растворе при энергичном восстановлении Cr(III), но
получить Mo(II) и W(II) довольно трудно. Образующийся W(II) легче окисляется,
чем Mo(II). Интересно сопоставить состояние в степени окисления III и
стабильность для всех первых членов семейств переходных металлов –
22Ti3+,
23V3+,
24Cr3+,
25Mn3+,
26Fe3+,
27Co3+.
Ti(III) и V(III) легко окисляются до M(IV) и поэтому являются восстановителями,
тогда как Fe(III) и Co(III) легко переходят в M(II) и поэтому проявляют
окислительные свойства. И железо(III),
и кобальт(III)
легко превращают I– в I2,
а Co(III) даже выделяет кислород из воды. Ион Cr(III) очень стабилен и
не является ни окислителем, ни восстановителем, а Mn(III) может быть окислителем
или восстановителем, что подтверждается его способностью и окисляться,
и восстанавливаться, образуя Mn(II) и Mn(IV) (реакция автоокисления).
Хром.
Спрос
на чистый хром невелик. В металлургическом процессе выделения хрома часто
используют процесс образования сплава с железом под названием феррохром,
который можно непосредственно добавлять в сталь. Для этого хромитную руду
Fe(CrO2)2
восстанавливают углем:
Fe(CrO2)2
+ 4C ®
(Fe + 2Cr) + 4CO
Чистый
хром получают восстановлением Cr2O3
алюминием или электролизом раствора, содержащего комплексные ионы (например,
цианидные) хрома. При выделении хрома электролизом образуется очень твердое
и прочное хромовое покрытие, которое используется для получения декоративных
и защитных пленок на подготовленных стальных поверхностях. Слой толщиной
всего 0,005 мм достаточно эффективен для удвоения срока службы некоторых
стальных изделий. Б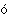 льшая
часть хрома расходуется в виде феррохрома для производства стали и придания
ей повышенной твердости и высокой прочности. Сталь с высоким содержанием
Cr, V, W и Ni используют для изготовления брони. Инструментальные и некоторые
конструкционные стали содержат много хрома. Хромоникелевые стали, содержащие
~18%
Cr и 8% Ni, часто применяют в химическом аппаратостроении, для изготовления
пищевой посуды и коррозионностойких емкостей. Нихромовая и хромелевая
проволоки (сплавы Ni–Cr)
используются в электротехнической промышленности, сплавы Cr–Co–W
отличаются особой твердостью и используются для производства режущего
инструмента. льшая
часть хрома расходуется в виде феррохрома для производства стали и придания
ей повышенной твердости и высокой прочности. Сталь с высоким содержанием
Cr, V, W и Ni используют для изготовления брони. Инструментальные и некоторые
конструкционные стали содержат много хрома. Хромоникелевые стали, содержащие
~18%
Cr и 8% Ni, часто применяют в химическом аппаратостроении, для изготовления
пищевой посуды и коррозионностойких емкостей. Нихромовая и хромелевая
проволоки (сплавы Ni–Cr)
используются в электротехнической промышленности, сплавы Cr–Co–W
отличаются особой твердостью и используются для производства режущего
инструмента.
Молибден
получают
из сульфидной руды MoS2.
Руду подвергают обогащению, обжигу до оксида MoO3
и переводят в CaMoO4,
прокаливая с CaCO3.
Образующееся соединение можно использовать в производстве стали непосредственно
без восстановления молибдата. Собственно металл
может быть получен из MoO3
восстановлением алюминием
или водородом. При прокаливании MoO3
с железом получается ферромолибден. Иногда чистый металл используют в электротехнике
для изготовления нитей, трубок, электрообмотки печей и электроконтактов.
Много высокомолибденистой стали расходуется на производство автомобилей.
Молибден можно использовать вместо W в сплаве с железом. Сталь с добавками
Cr:Ni:Mo = 16:25:6 используют для изготовления корпусов и двигателей самолетов
и баллистических ракет.
Вольфрам
получают
из оксида, извлекаемого из предварительно обогащенной руды, содержащей
до 60% WO3.
Cплавление оксида с основаниями дает водорастворимый вольфрамат типа Na2WO4.
При подкислении раствора выделяется осадок H2WO4,
который при термической обработке разлагается до WO3.
Металлический вольфрам выделяют восстановлением порошка оксида вольфрама
алюминием или водородом. Для получения компактной заготовки, пригодной
для механической обработки, порошок формуют при высоком давлении и специальной
термической обработке с поверхностным плавлением микрочастиц, но без полного
плавления вещества. Такой метод («порошковая металлургия») широко распространен
в технологиях сложных небольших форм для придания редких свойств изделиям.
Получаемый таким способом вольфрам идет также на изготовление нитей накаливания
в электрических лампах. Б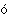 льшая
часть получаемого вольфрама используется как добавка в стали для придания
твердости, упругости, вязкости и жаропрочности. Металл применяют также
для изготовления электроконтактов, нагревательных элементов печей, нитей
в рентгеновских трубках, для получения высокотвердых материалов, например
карбида вольфрама WC. льшая
часть получаемого вольфрама используется как добавка в стали для придания
твердости, упругости, вязкости и жаропрочности. Металл применяют также
для изготовления электроконтактов, нагревательных элементов печей, нитей
в рентгеновских трубках, для получения высокотвердых материалов, например
карбида вольфрама WC.
Реакции.
Все
эти металлы образуют оксид MVIO3.
Оранжево-красный
CrO3
образуется из элементов, но обычно его получают при подкислении раствора
K2Cr2O7.
Оксид сильно отличается от аналогичных оксидов металлов этой группы, он
хорошо растворим, разлагается с выделением кислорода, образует многочисленные
нестехиометрические оксиды (например, Cr3O8
и Cr2O5),
прежде чем образуется Cr2O3.
CrO3
– хороший окислитель в органической химии.
Если в растворы молибдатов или вольфраматов
щелочных металлов (например, Na2MoO4
или Na2WO4)
добавить кислоту, то в осадок выпадают кислоты H2MoO4
и H2WO4
cоответственно. При прокаливании
таких осадков получают MoO3 и
WO3,
которые не реагируют с водой с образованием H2MoO4
и H2WO4.
В этом CrO3
тоже отличается от упомянутых оксидов, т.к. он является истинным ангидридом
(кислотообразующим оксидом), давая с водой кислоты H2CrO4
и H2Cr2O7.
Образование
оксидов.
Для всех этих металлов
известны оксиды в низших степенях окисления. Кроме упомянутых, можно получить
оксид хрома(II) CrO при окислении амальгамы Cr-Hg. Оксиды MoO2
и WO2
образуются при восстановлении
MoO3 и
WO3
водородом; известны также
Mo2O5,
W4O11
и W2O5.
Эти оксиды в действительности имеют более сложное строение. Хром также
образует оксид CrO2.
При восстановлении молибденовой и вольфрамовой кислот цинком получаются
окрашенные в голубой цвет нестехиометрические оксидные соединения, точный
состав которых неизвестен.
Амфотерность.
Амфотерность
рассматриваемых металлов проявляется в том, что они образуют оксоанионы,
комплексные соединения и кислоты. Так, CrO3
при действии основания и
даже кислоты образует анионные соединения типа K2CrO4
или K2Cr2O7
и H2CrO4
или H2Cr2O7.
Соли калия играют важную роль в аналитической химии, являясь окислителями
для количественного определения железа, иодид-иона, а также для реакции
осаждения яркожелтого хромата свинца. Между кислотами хрома существует
равновесие:
2HCrO4–
+ 2H+
 H2Cr2O7
+ H2O
H2Cr2O7
+ H2O
В
кислой среде преобладают бихромат-ионы, в щелочной – хромат-ионы.
H2CrO4
– достаточно сильная
кислота, диссоциирующая на H+
и HCrО4–,
но получить NaHCrO4
невозможно, так как в растворе ион HCrO4–
димеризуется в Cr2O72–
(см. уравнение выше).
Молибдаты MoO42–
и вольфраматы
WO42–
образуются при взаимодействии MO3
с основаниями. При подкислении
растворов этих солей происходит полимеризация в результате реакции конденсации
(с выделением воды) и образования связей типа М–О–М. (Это
свойство не наблюдается у больших ионов непереходных элементов и, очевидно,
объясняется отсутствием склонности к образованию двойных связей и сильной
тенденцией к образованию одинарной связи с окружающими группами ОН–.)
Такие полисоединения классифицируют по количеству оксометаллических единиц.
Если в соединении один и тот же металл координирует анионные группы и
входит в их состав, то такие соединения называются изополисоединениями
(типа кислоты или соли), например, [Mo(Mo6O24)]6–
и [(W12O41)]10–.
Если в состав такого иона входят два атома разных элементов, то соединение
называется гетерополисоединением (кислота или соль), например, H4[SiMo12O40],
H3[AsMo12O40]
и H10[FeIIMo6O24].
Структура этих соединений представляет собой цепь MoO6-октаэдров,
соединенных по граням со вторым металлическим атомом (Si или As).
Бронзы.
При
нагревании вольфрамата (например, K2WO4)
с W образуется золотисто-желтое твердое вещество, обладающее высокой проводимостью
(например, KWO3;
можно предположить, что металлический W
окислился до степени окисления V. В действительности строение, очевидно,
соответствует расположению металлического K
в структуре WO3).
Такие соединения получили название «бронзы» и характерны также для других
металлов и оксидов металлов.
Галогениды.
Металлы
этой подгруппы различаются по способности образовывать галогениды. Хром
не образует MX6,
даже CrF6.
Молибден образует только MoF6,
а вольфрам при прямом синтезе образует WF6,
WCl6
и WBr6.
Фторид бесцветен, а хлорид и бромид окрашены. Известны также пентагалогениды
CrF5 и
MoF5.
Cr(III) образует гидрат хлорида CrCl3Ч6H2O,
который имеет изомеры (см.
ниже). Галогениды других металлов
изомеров не имеют. Хром отличается большим многообразием комплексных соединений.
Например, молекулы воды и хлорид-ионы как доноры электронных пар способны
образовывать с ионом хрома комплексные ионы октаэдрического строения,
как в изомерах комплексного гексагидрата трихлорида хрома(III)
CrCl3Ч6H2O:

При
восстановлении CrCl3
можно получить CrCl2.
Молибден образует необычный галогенид состава Mo6Cl12.
Можно предполагать, что это изополисоединение [Mo6Cl8]Cl4.
При
гидролизе галогенидов образуются оксокатионы и соединения типа хромилхлорида
CrO2Cl2,
но данное соединение обычно получают по реакции K2Cr2O7
с конц. HCl. Хромилхлорид – летучее соединение. WX6
и MoX6
гидролизуются, образуя соответственно WO2Cl2
и Mo2OCl2.
Такие же соединения получаются при обработке диоксидов хлором. При гидролизе
WF6
получается WOF4.
Среди галогенидов известны также оксокомплексные соединения типа Na2[WO3F2],
K2[MoO2F4]
и Cs[CrOCl5].
В последнем соединении реализуется редкая для хрома степень окисления
V.
Сульфиды.
Металлы
в реакциях с серой образуют сульфиды различного состава, например Cr3S4,
Cr2S3
и CrS, при этом возможно
образование нестехиометрических сульфидов. MoS2
встречается в природе в виде молибденита.
Известен тиовольфрамат-ион WS24–,
который при подкислении превращается в WS3.
ПОДГРУППА VIIB. СЕМЕЙСТВО МАРГАНЦА
МАРГАНЕЦ, ТЕХНЕЦИЙ, РЕНИЙ
Электронная
конфигурация этих элементов – марганца Mn, технеция Tc, рения Re
– характерна для переходных металлов. Каждый элемент имеет наполовину
заполненную внутреннюю d-оболочку,
т.е. имеет пять d-электронов
на пяти d-орбиталях
и 2 электрона на внешней s-орбитали.
Исходя из факта наполовину заполненной каждой d-орбитали
можно предсказать некоторые свойства элементов. Соединения марганца(II)
отличаются хорошей устойчивостью к окислению и восстановлению, а соединения
Mn(III) склонны переходить в соединения Mn(II). Все элементы подгруппы
покрываются пассивирующей пленкой; при разрушении пленки Mn становится
реакционноспособным и вытесняет водород из кислот HCl и H2SO4.
Ни Tc, ни Re не растворяются в кислотах, не являющихся окислителями. Все
металлы растворяются в HNO3,
причем технеций и рений окисляются до M(VII), образуя HTcO4
и HReO4,
а марганец переходит в M(VII) только под действием сильных окислителей.
Состояние M(VII) более стабильно для Tc и Re: Mn2O7
при нагревании взрывается, а Re2O7
и Tc2O7
устойчивы даже при выпаривании их растворов.
Все элементы подгруппы образуют соединения
в низких степенях окисления, но более тяжелые образуют более устойчивые
соединения. Состояние в степени окисления V не очень характерно, но некоторые
соединения и ионы описаны. В целом Tc по свойствам ближе к Re: оба образуют
сходные соединения и комплексные ионы. В подгруппе нет элемента, близкого
по свойствам к Mn. Марганец более всего похож по свойствам на железо –
элемент, стоящий за Mn в ряду переходных металлов. Re отличается исключительно
высокой температурой плавления, а по плотности ближе к платиновым металлам,
наиболее тяжелым из всех металлов (табл. 14).
Таблица
14. МАРГАНЕЦ, ТЕХНЕЦИЙ, РЕНИЙ
Марганец
занимает
важное место среди стратегических металлов, так как для производства каждой
тонны стали требуется ок. 5,5 кг марганца. Большую часть марганца получают
из пиролюзита MnO2,
который существует в нескольких аллотропных модификациях – от относительно
хорошо закристаллизованных до почти аморфных. Металл получают восстановлением
углеродом или алюминием из диоксида марганца. Руду нагревают до высоких
температур в электрических печах в присутствии генераторного газа (влажный
CO) с последующей обработкой продукта серной кислотой для получения MnSO4,
из которого марганец выделяют электролизом. Эту же соль можно окислить
до товарного продукта MnO2,
используемого в технологии аккумуляторов. Около 90% Mn идет на производство
железомарганцевых сплавов, получаемых термической обработкой смеси MnO2
с углеродом и оксидами железа. Один из двух таких важнейших марганецсодержащих
продуктов – ферромарганец состава Mn:Fe = 8:2, другой – «зеркальный
чугун», получаемый из шихты Mn:C:Fe = 25:5:70 в доменной печи и применяемый
для раскисления и обуглероживания стали. Марганец связывает серу, содержащуюся
в стали, в безопасный для стали MnS. Это очень важно, так как высокая
концентрация серы в стали вызывает ее охрупчивание при высоких температурах,
что препятствует горячей обработке стали. Марганцевые стали обладают высокими
механическими характеристиками и пригодны для изготовления рельсов, сейфов
и механизмов, а с добавками Cu, Zn и Sn (бронза) устойчивы к коррозии
в морской воде и используются для изготовления корабельных винтов. Большие
количества MnO2
определенных модификаций расходуются на производство сухих аккумуляторов.
Некоторое количество MnO2
расходуется в производстве стекла для удаления зеленой окраски, вызванной
примесью железа. Другое применение марганца – в качестве дезинфицирующего
средства в виде KMnO4;
перманганат калия – хороший реагент для количественного анализа
многих веществ, например Fe, Ti, иодид-иона и др.
Технеций
–
искусственный элемент. Впервые Tc был получен в 1937 при бомбардировке
молибдена нейтронами и дейтерием:

В
ядерном реакторе заметные количества Tc получаются из изотопа 9942Mo
– продукта распада  . .
Конечным
продуктом распада 9943Tc
является стабильный изотоп
рутения 9944Ru.
Для отделения Tc от U их переводят в хлориды, после обработки пероксидом
водорода получают UO2Cl2
и действием сероводорода на получившийся раствор с добавлением к нему
PtCl4
осаждают Tc2S7
и PtS2.
Осадок сульфидов растворяют в гидроксиде аммония, из которого после добавления
кислоты перегонкой выделяют Tc2O7.
Металлический технеций получают из пертехнетата аммония NH4TcO4,
превращая его в оксид и восстанавливая последний водородом.
Рений.
Металлический
рений получают водородным восстановлением перрената аммония NH4ReO4.
В природе рений встречается чаще в рудах молибдена, чем марганца, как
можно было бы предполагать исходя из общности их подгруппы. Сегодня рений
получают в количестве, достаточном для промышленного применения, например,
при каталитическом гидрировании. Термоэлектронная эмиссия рения более
технологична, чем у вольфрама, и поэтому находит применение в специальном
оборудовании.
Реакции
и соединения.
Все эти металлы реагируют
с галогенами, однако степени окисления, проявляемые марганцем, сильно
отличаются от степеней окисления более тяжелых металлов. Марганец не проявляет
высоких степеней окисления, образуя лишь MnF2
и MnF3.
MnF3
– хороший фторирующий агент, он легко разлагается, выделяя фтор,
хорошо растворяется в воде, что не характерно для соединений Mn(III),
но эти растворы не электропроводны, по-видимому, из-за димеризации. Рений
в реакциях со фтором образует соединения с более высокими степенями окисления,
например ReF4 и
ReF6.
При хлорировании марганца получается стабильный и хорошо растворимый в
воде MnCl2.
MnCl3
и MnCl4
существуют, но легко разлагаются. MnCl4
получается при действии
HCl на MnO2
(пиролюзит), однако MnCl4
даже при комнатной температуре разлагается на MnCl2
и Cl2,
что можно использовать как удобный метод получения хлора. Рений при взаимодействии
с хлором образует трихлорид ReCl3
и пентахлорид ReCl5.
Бром и иод с этими металлами образуют галогениды только в низших степенях
окисления металла, например MnCl2.
Комплексообразование.
Все
галогениды металлов подгруппы Mn, принимая электронную пару от галогенид-иона
(донора), образуют комплексные ионы и соединения. Вот некоторые примеры.
[ReF6]2–
– гексафтороренат(IV),
[ReCl6]2–
– гексахлороренат(IV), [MnCl4]2–
– тетрахлороманганат(II), [ReCl6]–
– гексахлороренат(V). Галогениды подвергаются гидролизу, образуя
оксогалогениды, которые можно получать и другими способами. Соединение
MnVIIO3F
получается при обработке KMnO4
фтороводородом. Оксохлорид рения(VI) ReOCl4
получается не только при гидролизе ReCl6,
но и при действии O2 на
ReCl5.
Известны оксогалогениды и другого состава, например ReVO2F,
ReVIIOF5,
ReVIOF4.
Ион Mn(II) является комплексообразователем большого количества ионов октаэдрического
строения, проявляя в соединениях координационное число 6. Многие ионы
и молекулы, способные предоставлять для химической связи электронную пару,
образуют такие комплексные соединения. Особый интерес представляют [Mn(SCN)6]4–
и [Mn(CN)6]4–,
так как эти ионы хорошо восстанавливаются электролитически, образуя с
K комплексы одновалентного, а возможно, и нульвалентного марганца.
Оксиды.
С
увеличением степени окисления уменьшается стабильность оксидов марганца.
При прямом окислении марганца получается MnO, но при нагревании образуются
Mn2O3,
MnO2
и Mn3O4,
в чем проявляется сходство марганца с железом. Гептаоксид марганца Mn2O7
образуется при добавлении к KMnO4
сильной кислоты, но даже при низкой температуре он легко разлагается,
часто со взрывом. Рений и технеций проявляют сходство, образуя гептаоксиды
либо при прямом окислении, либо при действии HNO3
на оксиды в низших степенях
окисления. Re2O7
и Tc2O7
значительно стабильнее, чем Mn2O7.
Известен также красный оксид рения ReO3.
Амфотерность.
Все
элементы подгруппы проявляют амфотерные свойства в низких степенях окисления
элементов. При нагревании MnO2
с основаниями образуются манганаты: Mn
IVO32–,
голубой MnVO43–,
зеленый и устойчивый до 500°
C MnVIO42–,
а также фиолетовый MnVIIO4–.
Манганат(V)-ион MnO43–
получают несколькими способами, среди которых – мягкое восстановление
MnO4–
иодид-ионом, действие основания на KMnO4
при высокой температуре.
Соответствующий ион ReO33–
не так хорошо изучен. Перренаты и рениевая кислота образуются при окислении
ReO2:
при сплавлении металла или ReO2
со щелочью получается перренат натрия NaReO4;
рениевая кислота HReO4
образуется в результате окисления ReO2
хлором. При обычном нагревании
ReO2
происходит реакция диспропорционирования с образованием Re0
и Re2O7.
Необычную степень окисления –I
рений проявляет при нагревании перрената с цинком, образуя KReЧ4H2O,
по-видимому, имеющий структуру плоского квадрата.
Другие
соединения.
Mn(II) образует с
сульфид-ионом бледнорозовый MnS, растворимый в кислотных растворах. MnS2
получается при прямом взаимодействии металла с серой, но Mn не проявляет
степень окисления IV, а образует соединение, подобное пириту FeS2.
Высшие сульфиды, известные для Re и Tc, имеют соответственно состав Re2S7
и Tc2S7.
При прямом синтезе марганца с C, N и Si получаются соответственно Mn3C,
Mn5N3,
MnSi и Mn2Si.
ПОДГРУППА VIIIB. ТРИАДЫ ЖЕЛЕЗА И
ПЛАТИНОВЫХ МЕТАЛЛОВ
Индивидуальные
триады VIIIB подгруппы имеют общий признак в том, что они занимают по
одному положению в периодической таблице, что объясняется огромным сходством
свойств элементов. Обозначение «B» для VIII группы не является необходимым,
так как нет VIIIA подгруппы, однако химические и физические свойства элементов
триад железа и платиновых металлов согласуются с общей классификацией
их как переходных элементов.
ТРИАДА ЖЕЛЕЗА: ЖЕЛЕЗО, КОБАЛЬТ, НИКЕЛЬ
Тот факт, что члены триады железа более
сходны друг с другом в своем переходном ряду, чем с элементами в столбцах
периодической таблицы, не является необычным, так как во всех подгруппах
первые члены подгруппы отличаются по своим свойствам. Температуры плавления
элементов триады железа высокие, но ниже, чем у предшествующих элементов,
находящихся в серединах серий переходных металлов. В табл. 15 приведены
свойства, характеризующие сходство радиусов атомов, ионов и некоторых
термических свойств.
Таблица
15. ЖЕЛЕЗО, КОБАЛЬТ, НИКЕЛЬ
Железо
– первый элемент в переходных рядах, имеющий спаренный электрон
на внутренней d-орбитали.
Спаренные электроны с такой орбитали труднее участвуют в образовании химической
связи, чем неспаренные. Особенности внутреннего орбитального строения
всех металлов этой триады проявляются в наличии у них сильных магнитных
или ферромагнитных свойств. В магнитном поле атомы этих металлов ориентируются
так, что металлы образуют постоянные магниты.
Все
металлы триады проявляют выраженное электроположительное поведение, металлическую
связь, хорошую проводимость и металлический блеск. Они достаточно инертны
в среде сильных окислителей и даже кислорода воздуха. В этих условиях
на их поверхности образуются тонкие и инертные пленки оксидов, а также
проявляется способность элемента предоставлять внутренние d-орбитали
для образования связей с другими атомами по донорно-акцепторному механизму
(например, от железа к хрому, вольфраму и другим металлам в процессах
сплавления). Ни один элемент из триады железа не проявляет максимальной
степени окисления VIII (в отличие от платиновых металлов). Все металлы
триады железа образуют многообразные соединения, проявляя степени окисления
II и III. Проявление высокой степени окисления и амфотерных свойств наиболее
характерно для железа.
Железо.
Железо – второй
(после алюминия) по распространенности металл, встречается в виде различных
руд, пригодных для переработки (табл. 15). В США, например, богатая руда
уже использована в сталелитейной промышленности. Железный рудник в районе
Месаби-Рейндж (шт. Миннесота) теперь содержит только бедную железом гранитоподобную
породу. Ее взрывают, извлекают, дробят и превращают в мелкий порошок.
При обжиге образуется оксид железа, проявляющий магнитные свойства, благодаря
чему из водной взвеси его отделяют от пустой породы магнитной сепарацией.
Магнитный оксид брикетируют обкаткой в барабане, затем слегка спекают
до получения окатышей, пригодных для доменного процесса. Таким способом
из бедной руды (~20%
оксида железа) получают почти чистый Fe3O4,
который совместно с известняком и коксом используется для выплавки чугуна
в доменной печи.
Современная доменная печь – это
цилиндрическая башня высотой около 30 м и диаметром около 8 м. Через горн
печи снизу вверх продувают подогретый воздух. Шихта в печи состоит из
железной руды, известняка (CaCO3)
и кокса. Подогретый воздух окисляет кокс c образованием СО и выделением
тепла, которое вызывает плавление шихты, при этом силикаты переходят в
CaSiO3,
или шлам. Далее происходит ступенчатое восстановление оксида железа, разное
в различных температурных зонах печи и зависящее от количества кислорода
и концентрации СO. Получаемый чугун содержит только 93% Fe, остальное
составляют C, Si, P и газовые включения азота, кислорода и других газов.
Для удаления примесей C, S и P проводят обжиг в отражательных печах. Добавки
определенных металлов сообщают сплаву твердость, вязкость, механическую
прочность и другие физические свойства, необходимые для стали. Кроме того,
полученный сплав обычно подвергают операциям отжига и закалки для создания
хорошей кристаллической структуры и распределения фаз. Основная масса
доменного чугуна – передельный чугун (С >
4%) – идет на переплавку в сталь в конвертерах, мартеновских или
электрических дуговых печах; литейный чугун (С 2,4–3,8%) применяют
в машиностроении для изготовления чугунного литья
(см. также
ЖЕЛЕЗО;
МЕТАЛЛЫ ЧЕРНЫЕ).
Кобальт.
Металлический кобальт
выделяют из руд, которые содержат много мышьяка, а также серебро в количестве,
достаточном для промышленной переработки. Руду плавят с флюсом для получения
сырого серебряного слитка, загрязненного штейна или сплава Co-As-Fe. Дополнительным
обжигом удаляют As и
Fe.
Оставшиеся металлы, в том числе значительное количество меди, переводят
в хлориды с помощью NaCl. Присутствующее серебро осаждают в виде AgCl.
Водной вытяжкой в раствор переводят соли Co и Ni, которые затем осаждают
в виде гидроксидов. Кобальт и никель очень похожи по химическим свойствам,
поэтому их трудно отделить друг от друга. Разделение достигается благодаря
тому, что Ni легко образует карбонил из NiO и CO, а кобальт – нет.
CoO восстанавливают
до металла алюминием.
Никель.
Никелевая руда в основном
содержит смесь сульфидов никеля, меди и железа. При обжиге с дутьем воздуха
и с песком в качестве флюса образуется смесь NiO и NiS. Б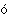 льшая
часть железа переходит в шлак в виде силиката железа. При плавлении NiO-NiS
в шахтной печи получают сплав Ni-Cu (штейн, который все еще содержит много
серы). Штейн прокаливают в конвертере Бессемера, увеличивая содержание
сплава Ni-Cu до 80%. Такой состав, все еще содержащий 20% серы, пригоден
для использования в металлургии. Из этого сплава получают монель-металл,
сплав, содержащий 70% Ni c добавками Cu, Fe и Mn. Чистые металлы можно
получать из штейна комплексной переработкой, включая образование сульфидов
в расплаве при добавлении Na2S.
При этом NiS осаждается из расплава, а сульфиды меди и железа остаются
в жидкой фазе. Полученный NiS после прокаливания образует NiO, из которого
при восстановлении углеродом получают металл. Для получения металла высокой
чистоты его растворяют и выделяют вновь электролитически. При этом среди
прочих примесей на никелевом электроде осаждаются и платиновые металлы,
которые с анода переходят в раствор при электролизе. Известен также карбонильный
метод очистки никеля (Монд-процесс), при котором никель окисляют до оксида,
затем получают летучий карбонил Ni(CO)4,
при
разложении которого образуется высокочистый никель. льшая
часть железа переходит в шлак в виде силиката железа. При плавлении NiO-NiS
в шахтной печи получают сплав Ni-Cu (штейн, который все еще содержит много
серы). Штейн прокаливают в конвертере Бессемера, увеличивая содержание
сплава Ni-Cu до 80%. Такой состав, все еще содержащий 20% серы, пригоден
для использования в металлургии. Из этого сплава получают монель-металл,
сплав, содержащий 70% Ni c добавками Cu, Fe и Mn. Чистые металлы можно
получать из штейна комплексной переработкой, включая образование сульфидов
в расплаве при добавлении Na2S.
При этом NiS осаждается из расплава, а сульфиды меди и железа остаются
в жидкой фазе. Полученный NiS после прокаливания образует NiO, из которого
при восстановлении углеродом получают металл. Для получения металла высокой
чистоты его растворяют и выделяют вновь электролитически. При этом среди
прочих примесей на никелевом электроде осаждаются и платиновые металлы,
которые с анода переходят в раствор при электролизе. Известен также карбонильный
метод очистки никеля (Монд-процесс), при котором никель окисляют до оксида,
затем получают летучий карбонил Ni(CO)4,
при
разложении которого образуется высокочистый никель.
Около половины получаемого никеля расходуется
в производстве стали для повышения ее коррозионной стойкости и твердости.
Он используется также для создания прочных покрытий на стальных изделиях;
хотя хромовые покрытия предпочтительнее, лучшие результаты получаются
при нанесении их на никелевую основу. Никелевый сплав пермаллой (78% Ni
и 21% Fe) обладает высокой магнитной проницаемостью, что делает его ценным
для использования в радиотехнике и системах связи. Американский «никель»
– пятицентовая монета – состоит из сплава 25% Ni и 75% Cu,
а «немецкое серебро» (нейзильбер) – это сплав Ni-Zn-Cu с соотношением
1:1:2; высококоррозионностойкий сплав, используемый для изготовления термопар
и обмотки катушек, состоящий из 74% Ni, 12% Fe, 11% Cr и 2% Mn, называется
нихромом. Мелкодисперсный никелевый порошок применяется как эффективный
катализатор гидрогенизации (например, конверсии масел в жиры).
Реакции.
Все металлы триады железа
реагируют с кислородом только при нагревании. Оксиды в низшей степени
окисления имеют состав MO. Однако железо не образует оксид такого стехиометрического
состава. В структуре оксида железа имеется дефицит железа и оксид отвечает
формуле Fe0,95O,
являясь нестехиометрическим соединением. При окислении Fe0,95O
происходит окисление Fe2+ в
Fe3+
с образованием Fe2O3.
При этом обычно образуется оксид промежуточного состава Fe3O4.
При добавлении щелочи к раствору соединений Fe2+
выпадает белый осадок Fe(OH)2,
который быстро окрашивается в результате окисления и образования красного
гидроксида железа(III) Fe(OH)3.
При нагревании в восстановительной среде Fe(OH)2
выделяет оксид состава,
близкого к FeO,
который легко возгорается на воздухе. Кобальт и никель образуют оксиды
строго стехиометрического состава CoO и NiO. В отличие от никеля, при
добавлении к раствору Co2+
щелочи образуется светлоголубой Co(OH)2,
быстро меняющий окраску на розовую и окисляющийся до состояния гидратированного
оксида кобальта(III). При прокаливании CoO образуется Co3O4.
Оксиды никеля и кобальта (NiO и CoO) получаются при разложении карбонатов
NiCO3
и CoCO3.
Соединения Co(III) окисляют воду с выделением кислорода.
Гидратированный диоксид никеля NiO2ЧxH2O,
получаемый электролитическим окислением NiO или Ni(OH)2,
применяют в технологии аккумуляторов – он служит катодом в никель-кадмиевых
батареях («никад», или NiO2-Cd),
а также в железо-никелевом аккумуляторе Эдисона. Железо не образует оксидов
со степенью окисления больше 3, но Fe(OH)3
или Fe2O3
можно окислить мощными окислителями в щелочной среде с образованием оксоанионов,
что иллюстрирует амфотерный характер железа. Из гидроксида Fe(III) действием
хлора в среде NaOH получают феррат(VI)-ион (FeVIO4)2–,
а из [Fe(OH)6]3–
действием кислорода в присутствии Ba(OH)2
получают феррат(IV)-ион (FeIVO3)2–,
и наконец, феррат(V)-ион (FeVO4)3–
образуется из соединений Fe(II) под действием KO2.
Соединения Fe(V) необычны для железа. Известен феррат(III)-ион FeIIIO2–,
образующийся из Fe2O3
и щелочи при высокой температуре; очевидно, что Fe(III) не проявляет ярко
выраженной амфотерности.
Галогениды.
Галогениды всех металлов
триады железа образуются при непосредственном взаимодействии металлов
с галогенами. Железо образует тригалогениды FeF3,
FeCl3
и FeBr3,
но не FeI3,
так как иодид-ион окисляется железом(III) до свободного иода. FeCl3
существует в виде димера Fe2Cl6
(даже при 750°
С в парах мало молекул мономера FeCl3),
в чем он сходен с Al2Cl6.
Кобальт со фтором образует CoF2
и CoF3,
причем трифторид – хороший фторирующий агент. Дигалогениды всех
металлов триады и тригалогениды железа легко образуют комплексные соединения,
как и следовало ожидать для переходных металлов. FeF3,
например, образует комплексные ионы FeF52–
и
FeF63–.
Cродство Fe(III) к OH–
проявляется в гидролизе с образованием основных солей Fe(OH)Cl2
и Fe(OH)2Cl.
Кобальт(III) – слишком сильный окислитель, чтобы образовывать простые
галогениды, хотя известны CoF3
и некоторые твердые соли Co(III), например Co2(SO4)3.
Комплексообразование.
Состояние
Co(III) можно стабилизировать в виде комплексного иона с помощью молекул
или ионов, являющихся донорами электронной пары. Количество комплексных
соединений Co(III) огромно и уступает, вероятно, только соединениям хрома.
Донорами электронов или лигандами могут быть галогениды, аммиак, амины,
диамины (например, этилендиамин NH2CH2CH2NH2),
цианиды, органические кислоты, альдегиды, кетоны и многие другие соединения.
Железо образует с цианид-ионом и ионом K+
темносиние комплексные ионы, например берлинскую лазурь KFe[Fe(CN)6].
Другим важным комплексным соединением железа является нитропруссид натрия,
красная соль состава Na2[Fe(CN)5NO]Ч2H2O,
один из редких примеров положительно заряженного лиганда в комплексе:
NO+
связан с Fe. Большой интерес для химиков представляет ферроцен Fe(C5H5)2
– комплексное соединение
Fe(II) c органической молекулой С5H6
(циклопентадиен) в качестве
лиганда, имеющее структуру из двух органических молекул, между плоскостями
которых находится железо. Такие соединения называются сандвичевыми. Аналогичные
соединения образуют Co (кобальтоцен)
и Ni (никелоцен).
Карбонилы.
Наиболее
необычный класс соединений представляют карбонилы, в которых переходный
металл с координированными карбонильными группами образует связь с ионом
металла или водорода. Пентакарбонил кобальта [Co(CO)5]
образует натриевую соль Na[Co(CO)5],
в которой степень окисления кобальта равна –I, так как степень окисления
CO равна 0. Другие необычные соединения известны для Ni, например, K2[NiI(CN)3],
K4[Ni0(CN)4].
В соединении H2[Fe(CO)4]
степень окисления железа равна –II.
Сульфиды.
Сульфиды
FeS,
CoS и NiS встречаются в составе природных руд. Их получают осаждением
сероводородом из растворов солей M(II). FeS можно получить также прямым
синтезом из металла и серы при нагревании, а также взаимодействием сероводорода
с Fe2S3
при высоких температурах (750–1000°
С) в атмосфере H2.
Стереохимия.
Соединения металлов триады
железа отличаются разнообразием строения. Двухвалентные Ni(II) и Co(II)
могут образовывать ионы со структурой типа плоского квадрата, тетраэдра
или октаэдра; комплексные соединения Co(III) и Fe(III), как правило, содержат
по 6 лигандов и имеют октаэдрические ионы, например
ТРИАДЫ ПЛАТИНОВЫХ МЕТАЛЛОВ
РУТЕНИЙ, РОДИЙ, ПАЛЛАДИЙ ОСМИЙ,
ИРИДИЙ, ПЛАТИНА
Свойства всех этих элементов сходны,
причем сходство внутри триад больше, чем в триаде железа. Чрезвычайно
ограниченная распространенность в природе платиновых элементов несопоставима
с распространенностью Fe, Co и Ni. Элементы обеих платиновых триад исключительно
инертны при обычных температурах, однако в мелкодисперсном состоянии и
при достаточно высоких температурах некоторые из них реагируют с кислородом,
хотя Rh, Ir и Pt совершенно инертны и в этих условиях. Металлы имеют очень
высокую плотность, а элементы второй триады – наивысшую плотность
из всех элементов периодической таблицы. Первый член каждой триады проявляет
наивысшую степень окисления и в этом отношении сходен с Fe. Это различие
в поведении связано с различной силой удерживания ядром внешних электронов.
Ниже на диаграмме показано распределение внешних электронов на орбиталях
(см. также электронную конфигурацию в табл. 16а), из которой следует
тенденция к заполнению (n –
1)d-орбиталей вместо ns-орбиталей.
При переходе от первого к последнему члену триады электроны, очевидно,
прочнее связываются с ядром и соответственно труднее большому количеству
электронов участвовать в образовании химической связи в соединении. Кроме
того, для образования соединения более пригодны электроны, участвующие
в связеобразовании с меньшей затратой энергии и в большем количестве,
т.е. из первых членов триад, чем из последних.
Распространенность
в природе. Платиновые металлы
очень редки в природе и не концентрируются в каких-либо географических
районах. Месторождения Co, Cu и Ni часто содержат и платиновые металлы.
В Уральских горах находятся богатые месторождения этих металлов. Разделение
платиновых металлов – многостадийная и наиболее трудная процедура.
Один из металлов – осмий – относительно легко выделяется,
так как он образует летучий тетраоксид. Pt и Pd можно выделить благодаря
их большей, чем у Ru, Rh и Ir, способности к образованию водорастворимых
хлорокомплексов. Любая технология разделения должна включать стадии отделения
Ag и Au, так как золото обычно сопутствует Pt и Pd, а серебро –
Ru и Rh.
Таблица
16а. РУТЕНИЙ, РОДИЙ, ПАЛЛАДИЙ, ОСМИЙ, РИДИЙ, ПЛАТИНА
Применение.
Наибольшее применение
платиновые металлы находят в ювелирной промышленности. Вторым по значимости
потребителем является химическая промышленность благодаря использованию
металлов в качестве катализаторов в процессе производства серной кислоты,
аммиака и гидрогенизации жиров. Металлы и их сплавы также находят важное
применение в производстве химической аппаратуры; например, в технологии
синтетического волокна применяются насадки и фильеры для получения волокна
и нитей, изготовленные из специальных платиновых сплавов. Родий применяют
для нанесения зеркальных покрытий в рефлекторах, прожекторах и т.д. Электроника
и стоматология вместе потребляют ~35%
платиновых металлов. Из Pt и ее некорродирующих сплавов изготавливают
мостовидные протезы, бюгели и т.п. Металлический Pd, составляющий около
40% всех продаж платиновых металлов, часто используется взамен Pt. Хлорид
Pd используют для обнаружения незначительных количеств ядовитого СО (монооксида
углерода) в газовых смесях. Так, 1 часть Pd на 10 000 частей раствора
позволяет обнаруживать присутствие CO по потемнению раствора при пропускании
воздуха, содержащего 0,0001 избыточного CO. Потемнение основано на восстановлении
Pd(II) под действием СО до Pd0.
Реакции
и соединения. Платиновые
металлы образуют разнообразные соединения, особенно много комплексных
соединений. Сильные окислители и коррозионно-активные реагенты, как HNO3,
царская водка (HNO3
+ HCl) и KHSO4,
не действуют на рутений, но Os при окислении образует тетраоксид. Азотная
кислота не действует на Rh, Ir и Pt, но Pd хорошо растворим в горячей
и концентрированной HNO3
c образованием Pd(NO3)2.
Pt и Pd взаимодействуют с царской водкой, образуя комплексные ионы со
степенью окисления (IV): [PdCl6]2–,
[PtCl6]2–.
При высокой температуре Rh, Ir и Pd реагируют с расплавом KHSO4.
При нагревании газообразные Cl2
и F2
взаимодействуют с платиновыми металлами, образуя галогениды: первая триада
– RuCl3
и RuF3,
RhCl3
и RhF3,
PdCl2
и PdF3,
вторая триада – OsCl4
и OsF6,
IrCl3 и
IrF6,
PtCl3 и
PtCl4.
Указанные соли образуются прямым синтезом из металла и галогена или по
специальным методикам при определенных температурах и концентрациях галогена
(табл. 16б).
|
Таблица 16б.
ГАЛОГЕНИДЫ ПЛАТИНОВЫХ МЕТАЛЛОВ
|
| |
Ru
|
Rh
|
Pd
|
Os
|
Ir
|
Pt
|
| Фториды |
RuF3
RuF5
|
RhF3
|
PdF2
PdF3
|
OsF4 OsF6
|
IrF3 (?)
IrF4
IrF6
|
PtF4 PtF6
|
| Хлориды |
RuCl3
|
RhCl3
RhCl4
|
PdCl2
|
OsCl2
OsCl3
OsCl4
|
IrCl
IrCl2
IrCl3
IrCl4
|
PtCl2
PtCl3
PtCl4
|
| Бромиды |
RuBr3
|
RhBr3
|
PdBr2
|
|
IrBr
IrBr2
IrBr3
|
PtBr2
PtBr3
PtBr4
|
| Иодиды |
RuI3
|
RhI3
|
|
OsI4
|
IrI2
IrI3
|
PtI2
PtI3
PtI4
|
Комплексообразование.
Малый радиус и большая
зарядовая плотность, а также наличие орбиталей для образования химической
связи определяют большое разнообразие комплексных соединений у каждого
иона платиновых металлов. Кислоты и соли с комплексным ионом получаются
при взаимодействии галогенидов с избытком галогеноводорода или галогенида
щелочного металла. Вот некоторые примеры: H2[PdCl4]
– из PdCl2
и HCl; H2[PtCl6]
– из PtCl4
и HCl;
K2[PtCl6]
– из PtCl4
и KCl;
K3[IrCl6]
– из IrCl3
и KCl.
Оксиды.
Галогениды металлов в
высшей степени окисления при термической диссоциации выделяют свободный
галоген и галогенид в низшей степени окисления или даже металл. Хлорокомплексы
могут быть получены по прямому взаимодействию платиновых металлов с хлором
в присутствии галогенидов щелочных металлов. Например, образование Na2[IrCl6]:
Ir
+ 2NaCl + 2Cl2
® Na2[IrCl6]
Другие
доноры электронной пары тоже взаимодействуют с ионами платиновых металлов
с образованием комплексных соединений. Монооксид углерода СО образует
с металлами комплексные соединения – карбонилы с М0,
например Ru(CO)5,
[Rh(CO)4]2.
Комплексные ионы с координационным числом 4 типа [PtCl4]2–
и [Pd(NH3)4]2+,
как правило, имеют строение плоского квадрата, а с координационным числом
6, например [Ru(NO2)6]3–,
[PtCl6]2–,
[OsCl6]2–
и [Rh(NH3)6]3+
– октаэдрическую координацию. Ионы Ru(II) и Ru(III) отличаются от
других, образуя комплексы с нейтральными молекулами SO2
и ионом NO+.
Уже
упоминалось, что металлы VIII группы
в порошкообразном состоянии с трудом, но могут образовывать оксиды. Наиболее
необычно происходит образование тетраоксидов первыми элементами триад
– Ru и Os. Осмий при взаимодействии с царской водкой образует OsO4,
как по реакции металла с O2.
Ru не окисляется непосредственно до RuO4.
При плавлении нитрата с Ru и щелочью образуется оксоанион RuO42–,
затем при окислении газообразным хлором получают RuO4.
Тетраоксид Ru менее стабилен, чем OsO4,
но оба устойчивы при сублимации. RuO4
более устойчив при повышенных температурах, чем при низких, разлагаясь
на холоду. Осмий образует осматы в двух высших степенях окисления: перосмат,
т.е. осмат(VII), OsO4–
и осмат(VI) OsO42–,
который получается при реакции OsO4–
со спиртом. В этих свойствах проявляется аналогия свойств с перманганат-
и манганат-ионами. Составы оксидов, образуемых платиновыми металлами,
приведены в табл. 16в.
|
Таблица 16в.
ОКСИДЫ ПЛАТИНОВЫХ МЕТАЛЛОВ
|
|
Рутений
|
Родий
|
Палладий
|
Осмий
|
Иридий
|
Платина
|
|
RuO2
RuO4
|
Rh2O
Rh2O3
|
PdO
PdOЧH2O
PdO2ЧH2O
Pd2O3ЧH2O
|
OsO2
OsO4
|
IrO2
Ir(OH)4
(или IrO2 Ч2H2O)
Ir2O3
|
PtO
PtOЧH2O
PtO2
PtO2ЧH2O
PtO3
P2O3ЧH2O
|
Поглощение
водорода. Платиновые
металлы проявляют необычные свойства: они проницаемы для газообразного
водорода и способны поглощать молекулы водорода, не образуя при этом определенных
соединений, но уменьшая прочность связи H–H и способствуя протеканию
реакций гидрогенизации (гидрирования).
Сульфиды.
Все платиновые металлы
образуют дисульфиды состава MS2.
При этом RuS2,
RhS2
и OsS2
имеют в структуре ион S22–,
как в пирите. Сульфаты с большой долей ионности связи известны для родия(III)
и иридия(III). Эти сульфаты образуют квасцы типа K2SO4ЧRh2(SO4)3.
ПОДГРУППА IB. МЕТАЛЛЫ ДЛЯ ЧЕКАНКИ
МОНЕТ
МЕДЬ, СЕРЕБРО, ЗОЛОТО
Как упоминалось в общем разделе о переходных
элементах, металлы IB и IIB подгрупп имеют заполненный 10
d-электронами
предпоследний, (n
– 1)-й
слой. В этом случае нет полного согласия с представлением
о том, что у переходных элементов
d-оболочка
находится в стадии заполнения. Считается, что отличительный электрон в
элементах каждого из этих семейств находится на внешней s-орбитали,
но на основании химических и физических свойств эти элементы относят к
переходным металлам. Действительно, в подгруппе IB внутренние d-электроны
обладают такой энергией, что по крайней мере два из них могли бы находиться
на внешних слоях. Они достаточно подвижны для участия в образовании химической
связи и не относятся к классической ситуации электронов на заполненной
d-оболочке.
Следует отметить, что d-электроны
элементов подгруппы IIB не участвуют в образовании химической связи в
соединениях. Все элементы подгруппы IB имеют в электронной конфигурации
ns1
электрон, который определяет их общие свойства и общую степень окисления
I. Медь и серебро проявляют также степень окисления II, хотя Ag2+
легко переходит в состояние Ag+,
что делает его прекрасным окислителем. Золото, в отличие от Cu и Ag, не
имеет степени окисления II, а наиболее стабильной степенью его окисления
является III. Cu и Ag могут проявлять степень
окисления III в жестких условиях
под действием сильнейших окислителей. Степени окисления выше III для этих
металлов не характерны, хотя вероятны.
Таблица
17а. МЕДЬ, СЕРЕБРО, ЗОЛОТО
Свойства.
Серебро имеет более низкие
температуры плавления и кипения, легче испаряется, чем медь и золото (см.
табл. 17а). Это означает, что металлические связи между атомами серебра
слабее. Заполненная целиком 4f-оболочка
золота создает полностью завершенный 32 электронами 4-й уровень, что приводит
к высокой плотности и малому радиусу его атома. Подвижность внешнего электрона
у элементов очевидна, так как они обладают высокой электропроводимостью,
причем серебро наивысшей. У меди и серебра потенциалы ионизации почти
в два раза больше, чем у металлов подгруппы IA,
что указывает на относительную инертность Cu
и Ag.
Еще алхимики назвали эти металлы «благородными», чтобы отличать их от
всех «неблагородных», проявляющих высокую реакционную способность, например
Pb и Sn. Все три металла – Cu,
Ag, Au – обладают высокой
пластичностью, но особенно отличается золото. Из золота можно изготовить
фольгу толщиной около 0,00001 см, а из 1 г золота вытянуть проволоку длиной
до 3000 м.
Применение.
Благородные металлы традиционно
использовались для чеканки монет (см.
табл. 17б). Но в настоящее время золото не используется в монетных сплавах
– оно служит всеобщим эквивалентом, в котором выражается стоимость
всех других товаров. Серебро и золото широко применяются в ювелирном деле,
а все три металла используются для изготовления украшений, декоративных
столовых изделий и др. Применение золота зависит от его чистоты; чистоту
можно определять в величинах пробы (чистое золото – 1000 единиц
пробы) или в каратах (чистое золото имеет 24 карата). Высокая коррозионная
стойкость, устойчивость к окислению, а также красивый внешний вид делают
металлы этой группы весьма ценными для различного декоративного применения.
Благодаря высокой отражательной способности серебро используют при изготовлении
зеркал, особенно в области видимого и инфракрасного излучения, а алюминий
более выгоден для рефлекторов, работающих в ультрафиолете. Серебряный
припой (сплав Ag-Pb) применяют в пайке меди с медью, а также в производстве
ламп накаливания.
|
Таблица 17б.
НЕКОТОРЫЕ МЕДНЫЕ СПЛАВЫ
|
| Алюминиевая
бронза |
90–98% Cu, 2–10% Al |
| Латунь |
60–82% Cu,
18–40% Zn (может также содержать немного Sn и Fe) |
| Бронза |
70–95% Cu, 1–25% Zn, 1–18% Sn |
| Пушечная
бронза |
90% Cu, 10% Sn |
| Колокольная
бронза |
78% Cu, 22% Sn |
| Нейзильбер
(«немецкое серебро») |
56–60% Cu, 20% Zn, 20–25% Ni |
| Никелевая
чеканка |
75% Cu, 25% Ni |
| Серебряная
чеканка |
10% Cu, 90% Ag |
| Золотая
чеканка |
10% Cu, 90% Au |
| Стерлинг |
7,5% Cu, 92,5% Ag |
Месторождения
и металлургия. Металлы
для приготовления монет мало распространены и, хотя встречаются в свободном
состоянии, сильно рассеяны. Уникальный агломерат элементной меди массой
более 3 т имеется в выставочном отделе Смитсоновского института. Все металлы
подгруппы IB с древних времен получают термическим разложением оксидов
или сульфидов. Природные ресурсы свободных металлов в сколько-нибудь значимых
отложениях близки к истощению. Сегодня экономичны только крупномасштабные
разработки месторождений.
Золото
имеет очень высокую плотность,
благодаря чему его отмывают от более легкой породы и в результате золото
остается на дне промывного желоба. Более привлекательны методы, в которых
большие объемы золотоносных шламов промывают мощными потоками воды в специальных
каналах. Для обработки отходов также имеется несколько технологий. Шламы
пропускают над медно-ртутной поверхностью, в результате золото образует
со ртутью амальгаму. Ртуть из амальгамы извлекают цианированием. В присутствии
кислорода цианид натрия образует с золотом растворимый в воде комплексный
ион [Au(CN)2]–,
из которого золото вытесняют цинком:

Такие
же методы применимы для получения серебра. Другой метод извлечения золота
заключается в обработке его хлором с образованием растворимого в воде
AuCl3
с последующим выщелачиванием золота из раствора.
Серебро.
Серебро
получают в основном из технологических отходов производства меди и свинца.
Серебро отделяют от свинца, используя хорошую растворимость Ag в цинке
и плохую растворимость цинка в расплаве свинца. Небольшое количество цинка
добавляют к серебросодержащему свинцу, Ag растворяется в Zn и поднимается
на поверхность расплава, с которой его снимают. Затем цинк из серебра
отгоняют. Остатки свинца в осадочном серебре удаляют окислением. Окончательной
процедурой получения серебра является электролиз или электрорафинирование.
Медь.
Из этой подгруппы медь
является наиболее нужным в промышленности металлом. Электрические провода,
трубы, емкости для химической промышленности в больших количествах изготавливают
из меди. Руды сегодня содержат <
1% меди, поэтому приходится перерабатывать многие тонны руды. Переработку
медных сульфидных руд.
Кроме меди высокой чистоты, в промышленности
применяются разнообразные медные сплавы. Некоторые из них приведены в
табл. 17б. Другие сплавы обсуждались ранее, такие, как медь-бериллий,
из которых изготавливают неискрящий инструмент; сплавы с марганцем, используемые
для изготовления коррозионностойких материалов для пропеллерных мешалок.
Реакции
и соединения. Все
металлы подгруппы – Cu, Ag,
Au – устойчивы к действию
кислорода, причем наиболее инертно золото. На них не действуют холодные
кислоты, такие, как HCl и H2SO4,
но Cu и Ag растворимы в горячей H2SO4,
а также в холодной и горячей HNO3.
Золото растворяется в смеси HCl и HNO3
(царская водка), образуя HAuCl4,
золотохлористоводородную кислоту. С галогенами эти металлы образуют галогениды.
Оксиды.
При прямом синтезе с
кислородом медь и серебро образуют Cu2O,
CuO и Ag2O.
Оксид CuO можно получить также из ионов Cu(II)
и OH–
при осторожной низкотемпературной
дегидратации (для предотвращения образования Cu2O).
Оксид меди(I) Cu2O
при растворении в минеральных кислотах (HCl или H2SO4)
образует соли меди (II), а не меди(I),
из-за реакции диспропорционирования Cu(I) в растворе:
2Cu+
® Cu0
+ Cu2+
Аналогично
ведет себя и Au(I):
3Au+
® 2Au0
+ Au3+
Состояние
Cu(I) сохраняется в растворе только при образовании комплексного иона.
Оксиды
Cu2O
и Ag2O
должны, казалось бы, проявлять сходные свойства, но в действительности
они различаются. Cu2O
термически неустойчив и разлагается на кислород и Cu0.
Простые соли серебра легко образуются из Ag2O,
но из Cu2O
невозможно получить соли Cu(I). Оксиды Au(I) и Au(III) стабильны.
Вот некоторые заключения о необычных
состояниях окисления металлов подгруппы:
1) Металлическая медь легче образует
Cu2+,
чем Cu+,
поэтому из Cu0
невозможно получить Cu+,
так как получается Cu2+.
2)
Металлическое серебро легче образует Ag+,
чем Ag2+.
3)
Au легче образует Au3+,
чем Au+.
4)
Переходы Cu+
® Cu3+
и Ag0
® Ag3+
возможны только под действием сильных окислителей. Поэтому медь и серебро
в виде простых ионов Cu3+
и Ag3+
в растворе не существуют.
5)
Au3+
как окислитель существенно хуже, чем Cu3+
и Ag3+.
6) Ag+
– весьма стабильный ион в растворе, тогда как Cu+
и Au+
в растворе самопроизвольно диспропорционируют.
Амфотерность.
CuO и Cu(OH)2
проявляют слабую амфотерность и в сильнощелочной среде образуют [Cu(OH)4]2–.
Металлическая медь в присутствии кислорода растворяется в концентрированном
растворе аммиака, образуя комплексное соединение [Cu(NH3)4](OH)2,
которое обладает редким свойством – оно способно растворять соединения
целлюлозы и хлопок. Au2O3
– амфотерное соединение, в реакции со щелочью образует NaAuO2.
Ag2O
– практически полностью основной оксид.
Галогениды.
Галогениды металлов подгруппы
IB проявляют более предсказуемые свойства, чем оксиды. Известны галогениды
Cu(I) (CuF, CuCl, CuBr и CuI,
но CuF в растворе диспропорционирует на CuF2
и Cu0).
CuF получают по реакции обмена CuCl с HF или прокаливанием CuF2
в атмосфере HF при 1000°
С. Эти галогениды имеют белый цвет, что соответствует иону Cu с полностью
завершенной (n
– 1)d-оболочкой.
Для Cu(II) известны все галогениды, кроме CuI2,
который диспропорционирует до CuI
и I2.
Окраска CuF2,
CuCl2
и CuBr2 белая,
желто-коричневая
и черная соответственно. Все галогениды меди(I) и меди(II) в избытке галогена
или HX образуют растворимые комплексные соединения с ионами CuI32–,
CuCl2–,
CuCl32–,
CuCl42–.
Серебро
со всеми галогенами образует нерастворимые в воде моногалогениды AgF,
AgCl, AgBr и AgI.
Существует определенная взаимосвязь между усилением окраски, уменьшением
растворимости и уменьшением ионного характера связи в этих галогенидах.
Несколько неожиданно, что твердый AgF имеет желтоватую окраску, а раствор
Ag+F–
бесцветен. AgCl, AgBr и AgI
окрашены в белый, кремовый и чисто желтый цвета соответственно.
AgBr благодаря своей светочувствительности
широко используется в фотографии (в производстве пленки и фотобумаги).
Микрокристаллические частицы AgBr на поверхности пленки или фотобумаги
на свету сенсибилизируются в большей или меньшей степени в зависимости
от количества света, засветившего пленку. Затем на пленку действуют органическим
восстановителем, и при этом экспонированные частицы AgBr превращаются
в металл Ag. Непрореагировавшие частицы AgBr удаляются при закреплении
изображения с помощью тиосульфата натрия Na2S2O3
(гипосульфит), который образует стабильный и растворимый комплексный ион
[Ag(S2O3)2]3–,
отмываемый из пленки. Высушенная пленка является негативом с темным изображением
на местах сильной экспозиции. Позитив получают, просвечивая пленку, лежащую
на фотобумаге, покрытой аналогичным химическим составом. После проявления
и закрепления наиболее светлые места на фотобумаге соответствуют максимальной
яркости при экспозиции. В определенных единичных тонах (как сепия) возможно
применение сульфидов для превращения Ag в Ag2S
и замена серебра на платиновые металлы.
Благодаря сильному окислительному действию
фтора серебро образует соединения с высокой степенью окисления –
AgF2
и AgF3.
Под действием фтора хлориды переходят во фториды. В избытке галогенид-ионов,
как и в случае меди, образуются комплексные ионы Ag(I).
Например, из AgF или
AgCl
образуются AgF2–
и AgCl2–.
Известны также соединения, которые очень сходны с галогенидами; их даже
называют псевдогалогенидами, например цианид серебра AgCN, тиоцианат серебра
AgSCN, азид серебра AgN3.
У
золота наиболее устойчивый галогенид AuF3,
однако в избытке HF он гидролизуется до Au(OH)3.
Это не слишком необычно для такого высокозарядного иона с большой плотностью.
AuCl3
в соответствии со своим строением является димером Au2Cl6.
При восстановлении AuCl3
или HAuCl4
водородом или SnCl2
образуется вещество глубокого пурпурового цвета, возможно, мелкодисперсная
смесь Au + SnO2.
Среди множества других известны комплексные ионы золота (псевдогалогениды)
состава [Au(CN)4]–
и [Au(SCN)4]–.
Органические вещества, имеющие донорную электронную пару, также образуют
различные комплексы с Au(III). Золото образует некоторые 6-координационные
ковалентные ионы, например AuF63–,
но более распространены тетраковалентные ионы типа AuX4–.
Амминокомплексы.
Аммиак в водном растворе
NH3ЧH2O
образует с ионом серебра и рядом нерастворимых солей растворимые амминокомплексы;
аналогичные реакции идут с медью:

И
только наиболее нерастворимые соли серебра (AgI и Ag2S)
не образуют амминокомплексов. Серебро легко выделяется из комплексов в
виде зеркального покрытия на стекле под действием слабых органических
восстановителей. Растворы аммиачных комплексов серебра очень неустойчивы,
образуют Ag3N
и Ag2NH,
которые взрываются без видимых причин (сотрясения или удара).
Сульфиды.
Сульфиды рассматриваемых
металлов мало похожи на оксиды. Медь образует CuS и Cu2S
(последнее соединение не является стехиометрическим). CuS вследствие очень
низкой растворимости выпадает в осадок при добавлении H2S
даже из кислых растворов. Сульфид Cu(I) образуется из CuS при избытке
H2S
или термической диссоциации CuS. В серусодержащей атмосфере на поверхности
серебра образуется темный или черный осадок сульфида серебра. Такой налет
на столовой посуде удаляется с трудом с помощью комплексообразования серебра
или электрохимическим вытеснением из AgS. AuS не существует, а сульфид
Au(III) осаждается из растворов комплексов Au(III) и растворяется в Na2S
с образованием NaAuS2.
Другие
соединения. Упомянем
некоторые соединения подгруппы IB. Широко известен пентагидрат сульфата
меди(II) CuSO4Ч5H2O
(медный купорос), используемый как фунгицид вместе с арсенитом меди CuHAsO3
и ацетатом меди Cu(CH3COO)2.
При прокаливании кристаллогидрата сульфата меди происходит ступенчатая
дегидратация и образуется безводный сульфат белого цвета, а при термической
обработке большинства других солей получаются основные соли, например,
из CuCl2Ч5H2O
получается CuCl2ЧCu(OH)2.
Соли
меди(III) можно синтезировать только с помощью сильных окислителей, например,
из CuO и KO2
образуется KCuO2;
Na9[Cu(TeO6)2]
получается при электролитическом окислении в щелочной среде; известны
также K3[CuF6]
и K7[Cu(IO6)2].
Оксид серебра Ag2O2
(или AgIAgIIIO2)
имеет промышленное значение для изготовления электродов в серебряно-цинковых
элементах и аккумуляторах. Серебро проявляет степень окисления III в AgF3
и некоторых комплексных соединениях, в которых органические лиганды стабилизируют
высокую степень окисления серебра.
ПОДГРУППА IIB. СЕМЕЙСТВО ЦИНКА
ЦИНК, КАДМИЙ, РТУТЬ
Положение элементов семейства цинка
как членов рядов переходных металлов, рассмотрено ранее (см.
разд. Подгруппа IB и Переходные элементы). Хотя валентный электрон, отличающий
их от элементов подгруппы IB,
поступает на ns-уровень
и у каждого из них заполнена (n
– 1)d
10-орбиталь, по своим химическим
и физическим свойствам они все-таки очень отличаются от B-подгрупп; в
то же время существует некоторое сходство с непереходными металлами. Так,
есть аналогия с элементами подгруппы IIA – все они проявляют степень
окисления II. Эти переходные металлы имеют сравнительно невысокую плотность,
низкие температуры плавления и кипения, проявляя тем самым сходство с
непереходными металлами. Температуры плавления и кипения, в целом, увеличиваются
к серединам рядов переходных металлов и затем постепенно, но нерегулярно,
уменьшаются, поэтому металлы, завершающие серии переходных элементов,
должны иметь относительно низкие значения этих величин, что мы и видим
в табл. 18. Однако удивительно, что у этих элементов ионные радиусы M2+
меньше ионных радиусов M+
элементов подгруппы IB, хотя металлический радиус заметно больше. Неожиданное
увеличение атомного радиуса цинка нарушает закономерность сжатия, начинающуюся
с подгруппы IIIB вдоль рядов переходных металлов. Большие значения потенциалов
ионизации (энергия, затрачиваемая на отрыв внешних электронов от атома,
находящегося в газообразном состоянии) для элементов IIB подгруппы выглядят
странно на фоне легкости, с которой Zn и Cd реагируют с кислотами-восстановителями
(например, с HCl), вытесняя водород. Исчерпывающее объяснение этому находится
за пределами данного рассмотрения, однако причина связана с реальным количеством
энергии, выделяющимся при образовании ионов в растворе (энергия гидратации).
Другой
тенденцией, отличающей их от непереходных элементов, т.е. элементов A-подгрупп,
является то, что цинк проявляет только степень окисления II, а кадмий
реализует степень окисления II как наиболее стабильную, но может давать
соединения и со степенью окисления I, и, наконец, для ртути стабильны
обе степени окисления (I и II). Эта тенденция к проявлению низких степеней
окисления нехарактерна для непереходных элементов. 6s2-Электронная
пара ртути близка по поведению к инертной электронной паре. Например,
у висмута инертная электронная пара стабилизирует состояние в низшей степени
окисления III и дестабилизирует состояние V. Внутренний заполненный слой
из 18 электронов сохраняется у каждого элемента, так как эти электроны
не участвуют в образовании химической связи. В этой подгруппе больше сходства
между Zn и Cd,
чем между Cd и Hg, тогда как у непереходных элементов, наоборот, первый
член подгруппы отличается от других. Цинк и кадмий не так явно различаются,
как медь и серебро. Между подгруппами IB и IIB имеется небольшое сходство,
при этом элементы IIB-подгруппы более реакционноспособны. Первые члены
действительно имеют существенно более высокие электродные потенциалы.
Таблица 18. ЦИНК, КАДМИЙ,
РТУТЬ
Извлечение
металлов
из их сульфидных руд
не представляет слишком сложной задачи, так как все сульфиды достаточно
легко окислить до оксидов, а затем восстановить оксиды углеродом или металлом
при термической обработке. Перед переработкой сульфидную руду цинка (сфалерит
или цинковую обманку) подвергают обогащению, после грубого измельчения
примерно до размера гравия добавляют к гомогенному шламу (в больших танках),
состоящему из ферросилиция FeSi (получают в обжиговых печах сталеплавильной
промышленности). Плотность этого жидкообразного шлама достаточна для флотации
кремнистого материала из более тяжелых сульфидных руд ZnS в присутствии
примеси PbS. Дальнейшее обогащение руды достигается после пенной флотации.
Сульфид цинка при обжиге превращают в ZnO и затем восстанавливают до металла
коксом при температурах, достаточных для испарения цинка из зоны восстановления.
Если в руде присутствовал кадмий, его отделяют благодаря его большей летучести.
Чистый цинк получают электролизом аналогично процессу рафинирования меди.
Ртуть может быть как в свободном состоянии, так и в связанном в виде киновари
HgS. При обжиге на воздухе металл улетучивается из печи, так как при температурах
обжига HgO неустойчив и разлагается на ртуть с выделением кислорода. Сульфидная
сера образует SO2.
Очистку загрязненного материала проводят, отжимая через замшевый фильтр
с последующей обработкой азотной кислотой и повторной перегонкой без доступа
воздуха.
См. также
ЦИНКОВАЯ ПРОМЫШЛЕННОСТЬ.
Применение.
Металлы подгруппы находят
разнообразное применение. Большие количества цинка применяют для коррозионной
защиты железа и стали. Металлический цинк достаточно активен, но первоначально
в природных условиях образуется инертное защитное покрытие из основного
карбоната Zn2(OH)2CO3.
Цинковое покрытие можно получать разными способами – горячим погружением,
как в электролитических методах, испарением цинка с последующей конденсацией
на защищаемую поверхность, разбрызгиванием, распылением, напылением и
сушкой сформованного материала в больших печах. Много цинка расходуется
в производстве бронз и латуней из меди и цинка (см.
табл. 17б). Эти сплавы применяют для придания высокой коррозионной стойкости,
например, марганцевая бронза (90% Cu, 5% Zn, 3% Sn и 2% Mn) отличается
особой коррозионной стойкостью.
Кадмирование – один из способов
коррозионной защиты стальных поверхностей, однако это покрытие неустойчиво
к кислотам. Кадмий используют в технологии низкоплавких сплавов, например,
сплава Вуда (12,5% Cd), сплава Липовича (10% Cd). Кроме того, кадмий часто
добавляют в подшипниковые сплавы. Все металлы подгруппы IIB находят широкое
применение в технологии аккумуляторов и батарей. Например, цинк используют
как оболочку в сухих батареях, где он выполняет двоякую функцию, –
контейнера и анода; кадмий используют как анод в никель-кадмиевых элементах
типа щелочного аккумулятора Эдисона, в котором ставят кадмиевый анод вместо
железного; оксид ртути(II) применяют в ртутных элементах; в стандартном
элементе Вестона анод состоит из амальгамы Cd-Hg, а электролит –
из раствора CdSO4,
такой элемент отличается стабильным и хорошо сохраняющимся напряжением.
Ртуть – единственный из металлов,
который является жидкостью при обычной температуре (кроме ртути только
галлий и цезий имеют очень низкие (около 29°
С) температуры плавления, но они твердые при комнатной температуре). Ртуть
отличается большой химической инертностью, высокой электропроводностью
и находит разнообразное применение в электротехнических контрольно-измерительных
приборах, газоразрядных лампах, переключателях и контактах. Кадмий входит
в состав сплава, из которого сделаны регулирующие стержни в активных зонах
ядерных реакторов, так как ядро атома кадмия отличается большим сечением
захвата нейтронов.
Реакции.
Цинк и кадмий активно
реагируют со всеми кислотами и даже с водой (при достаточном нагревании),
вытесняя из них H2.
Реакции с кислотой протекают следующим образом:

Цинк
растворяется в щелочах с выделением водорода и образованием цинкат-иона
Zn(OH)42–.
Ртуть реагирует только с сильными кислотами-окислителями, такими, как
HNO3
и царская водка. При этом могут образовываться нитраты ртути(I) и ртути(II),
Hg2(NO3)2
и Hg(NO3)2.
В этом заключается, в частности, ее отличие от меди, которая тоже способна
проявлять степени окисления I и II, но с азотной кислотой образует только
Cu(NO3)2.
В зависимости от ряда факторов (размера реагирующих частиц, концентрации
кислоты и температуры) медь реагирует с HNO3
с образованием различных соединений. Из раствора выделяются газообразные
оксиды азота, азот и частично водород, в растворе образуются ион Cu(II),
NH2OH,
N2H4,
NH4+,
может образовываться осадок CuO.
Оксиды.
Все металлы подгруппы
(Zn, Cd, Hg)
при нагревании реагируют с кислородом. Цинк образует белый ZnO, который
при повышении температуры желтеет. Белый ZnO получается при термической
диссоциации солей оксокислот; его используют как пигмент. Кадмий при прямом
окислении образует коричневый оксид CdO, который при повышении температуры
до ~700°
C разлагается на кадмий и кислород. Напротив, ZnO исключительно стабилен
(см.
в табл. 18 более отрицательное значение энтальпии образования ZnO). Ртуть
медленно окисляется до HgO на воздухе при ~300°
С и вновь разлагается до металла
при температурах чуть выше этой. HgO имеет желтую и красную модификации.
Нет данных, свидетельствующих об образовании Hg2O.
Амфотерность.
Оксид цинка проявляет
типичные амфотерные свойства, реагируя как с основаниями, так и с кислотами
и образуя соответственно цинкат-ион Zn(OH)42–
и Zn2+.
Гидроксид цинка Zn(OH)2
получается по реакции с основанием, но в избытке основания растворяется,
образуя растворимый цинкат:
Zn(OH)2
+2OH–
 Zn(OH)42– Zn(OH)42–
При использовании раствора
аммиака в качестве основания тоже образуется вначале гидроксид, который
в избытке NH3
образует комплексный ион тетраамминцинка:
Zn(OH)2
+ 4NH3
 [Zn(NH3)4]2+
+ 2OH– [Zn(NH3)4]2+
+ 2OH–
Кадмий
образует аналогичный ион тетраамминкадмия [Cd(NH3)4]2–.
Оксид
и гидроксид кадмия в отличие от таких же соединений цинка не проявляют
амфотерных свойств. Кадмиат CdO22–
образуется только при сплавлении оксида кадмия(II) со щелочью. Оксид ртути(II)
тоже устойчив к действию оснований, но амфотерность ртути проявляется
в том, что HgS растворяется в растворе Na2S
с образованием тиомеркурат(II)-иона HgS22–.
Взаимодействие
с кислотами. При
обработке оксидов элементов подгруппы IIB кислотами образуются соли –
нитраты, сульфаты, галогениды, фосфаты и карбонаты. Карбонаты, нитраты
и сульфаты при термической диссоциации разлагаются с образованием CO2,
NO2,
SO3
(SO2
+ O2)
соответственно. Карбонат ртути(I) Hg2CO3
получается при смешении растворов Hg2(NO3)2
и карбоната щелочного металла. Образование Hg2CO3
свидетельствует об отсутствии гидролиза иона Hg(I).
Галогениды.
Все металлы подгруппы
реагируют с галогенами, образуя галогениды; галогениды получаются также
при действии галогеноводородов на оксиды и гидроксиды этих металлов. Хлорид
цинка ZnCl2,
получаемый хлорированием Zn, используют для консервации древесины. Расплав
ZnCl2
является умеренным электролитом, что свидетельствует о частично ионном
характере связи. Фторид цинка ZnF2
получают прямым фторированием цинка либо реакцией HF c ZnO или ZnCl2.
Кадмий со всеми галогенами образует CdIIX2,
а также CdICl.
Ртуть образует галогениды ртути(I) и ртути(II). Хлорид ртути(II) (сулема),
в отличие от хлорида ртути(I) Hg2Cl2,
растворим в воде. HgCl2
получают по реакции обмена
HgSO4
+ 2NaCl ®
HgCl2
+ Na2SO4
Из
раствора его выделяют
сублимацией. Сулема – высокотоксичное вещество. Хлорид ртути(I)
(каломель) нерастворим в воде, неядовит и находит ограниченное применение
в медицине как слабительное. Водному слою над осадком каломель придает
красивый шелковистый оттенок. Ион ртути(I) Hg22+,
или [Hg:Hg]2+,
имеет необычный для ионов металлов состав, но он существует, что подтверждено
результатами химических, электрохимических и спектральных исследований.
Ртуть металлическая и HgCl2
находятся в равновесии с Hg2Cl2:
Hg0
+ HgCl2
 Hg2Cl2 Hg2Cl2
Хлорид
ртути(II) – практически
полностью неионное соединение с ковалентным типом связи. Однако то, что
при действии H2S
на раствор HgCl2
или на раствор с ионом Hg22+
выделяется только HgS, подтверждает наличие определенного количества ионов
Hg2+.
Аналогично при действии гидроксид-иона образуется только гидроксид ртути(II)
Hg(OH)2.
Галогениды
металлов подгруппы IIB проявляют тенденцию к образованию галогено- и псевдогалогенокомплексов
при реакциях растворимых галогенидов или псевдогалогенидов, например:

Комплексообразование
настолько сильно выражено у Cd, что аутокомплексы существуют в растворах
солей кадмия (например, в растворе CdCl2):
2CdCl2
 Cd[CdCl4] Cd[CdCl4]
В
соединениях X–Hg–X (X – галоген) ковалентная связь столь
прочна, что комплексные соединения ртути намного менее стабильны, чем
соответствующие соединения цинка или кадмия. Поэтому в растворе HgCl2
преобладают ионы HgCl+ и
Cl–,
а добавление Cl–-иона
к раствору HgCl2
не увеличивает стабильность комплексных ионов типа HgCl42–.
При
взаимодействии галогенидов (а также других солей) ртути с аммиаком в зависимости
от его физического состояния (газ или раствор) получается белый плавкий
либо неплавкий осадок:
HgCl2
+ 2NH3
(газ)  Hg(NH3)2Cl2
(плавкий белый осадок)
Hg(NH3)2Cl2
(плавкий белый осадок)
HgCl2
+ 2NH3
(водн.)  NH4Cl
+ HgNH2Cl
(неплавкий белый осадок)
NH4Cl
+ HgNH2Cl
(неплавкий белый осадок)
Вторая
реакция тормозится в присутствии больших количеств хлорида аммония NH4Cl.
Среди других реакций для обнаружения аммиака в воде используется реактив
Несслера – щелочной раствор K2[HgI4].
При его взаимодействии с NH3
и солями аммония образуется красно-коричневый осадок:
2[HgI4]2–
+ NH3
+ 3OH–
® [OHg2NH2]I
+ 7I–
+ 2H2O
Образование
этого осадка возможно уже при ничтожных количествах аммиака в растворе.
Таким способом можно обнаруживать начало разложения (гниения) продуктов
животного или растительного происхождения. Известны и другие соединения
ртути с азотом, например, аммиачные комплексы типа иона тетраамминртути(II)
[Hg(NH3)4]2+,
получаемого из аммиака и соли ионного типа:
Hg(ClO4)2
+ 4NH3 [Hg(NH3)4]2+
+ 2ClO4–
[Hg(NH3)4]2+
+ 2ClO4–
Очевидно,
что ртуть имеет координационное число 2 (как в HgCl2
или [Hg(NH3)2]2+,
оба линейного строения) или 4, как в [Hg(NH3)4]2+
(тетраэдрического строения).
Гидриды.
Все металлы подгруппы
IIB
образуют гидриды состава MH2.
Так, гидрид цинка ZnH2 получается
при взаимодействии ZnI2
с LiAlH4
или LiH. Все гидриды реагируют с водой, выделяя водород, аналогично поведению
гидридов элементов подгрупп IA и IIA. Термическая устойчивость гидридов
убывает в ряду ZnH2
>
CdH2
>
HgH2,
причем HgH2
начинает разлагаться при –125°
С.
Сульфиды.
Сульфиды двухвалентных
металлов образуются по реакции прямого синтеза, а также при действии сероводорода
на растворы солей. Сульфид цинка ZnS – белое и растворимое в кислотах
вещество, одно время он как пигмент в смеси с наполнителем BaSO4
(литопон) широко применялся для приготовления красок, в производстве пластмасс,
линолеума и т.п. Сульфид кадмия CdS – светложелтое вещество –
также применяют как пигмент, но он растворяется только в сильных кислотах
или с окислителями. Для ртути известен только сульфид HgS, так как Hg22+
при обработке сероводородом
образует только HgS:
Hg22+
+ H2S
® Hg0
+ HgS + 2H+
Приведенная
реакция является реакцией диспропорционирования и хорошим доказательством
чрезвычайной нерастворимости HgS: только смесь HNO3
+ HCl растворяет этот сульфид.
Реакции
Льюиса. Все
ионы рассматриваемых металлов – Zn,
Cd, Hg – обладают большим
сродством к электронной паре, и поэтому можно полагать, что они являются
сильными кислотами Льюиса, однако ртуть в меньшей степени, чем цинк и
кадмий. Координационное число цинка преимущественно равно 4, но может
достигать и 6. Получение двух 6-координационных комплексных ионов с октаэдрической
структурой приведено ниже:
Zn2+
+ 6NH3
 [Zn(NH3)6]2+ [Zn(NH3)6]2+
Zn2+
+ 3NH2CH2CH2NH2
 [Zn(en)3]2+ [Zn(en)3]2+
Последнее
соединение представляет собой комплексный ион с бидентатными лигандами:
en – молекула этилендиамина
NH2CH2CH2NH2,
донор двух электронных пар.
АКТИНОИДЫ
Актиноиды
– гомологи лантаноидов, элементов подгруппы IIIB. Они содержат 15
элементов с атомными номерами от 89 до 103: актиний Ac, торий Th, протактиний
Pa, уран U и трансурановые элементы (нептуний Np, плутоний Pu, америций
Am, кюрий Cm, берклий Bk, калифорний Cf, эйнштейний Es, фермий Fm, менделевий
Md, нобелий No, лоуренсий Lr).
Все элементы радиоактивны и распадаются на другие элементы с меньшей атомной
массой (см.
табл. 19а).
Таблица
19а. АКТИНИЙ, ТОРИЙ, ПРОТАКТИНИЙ, УРАН
Актиний
открыт
А.Дебьёрном в 1899 и независимо от него в 1902 –
Ф.Гизелем. Название актиний происходит от греческого слова, означающего
«луч»; оно принято за способность
элемента к радиоактивному распаду,
при котором актиний распадается до стабильного изотопа свинца 207Pb,
испуская a-
и b-частицы.
В природе актиний встречается в урановой смоляной руде в количестве всего
0,15 мг на тонну, но для практических целей его получают искусственным
путем в миллиграммовых количествах при облучении радия в ядерных реакторах.
Химически актиний очень похож на редкоземельный гомолог лантан; каждое
соединение актиния можно получить тем же способом, что и аналогичное соединение
лантана. Физические свойства актиния приведены в табл. 19а.
Торий
открыт
Й.Берцелиусом в 1828. Элемент тоже радиоактивен, но не выделяется при
распаде радия. Природный изотоп тория 232Th
– потенциальный источник ядерной энергии, так как при бомбардировке
нейтронами превращается в 233U,
который может использоваться как ядерное топливо. Торий-232 обладает естественной
радиоактивностью, распадаясь до 208Pb
и испуская a-
и b-частицы.
В природе встречается в минералах монаците и торите в количествах, достаточных
для промышленной переработки. Металлический торий применяют в специальных
лампах (типа солнечных ламп) и в магниевых сплавах. У тория очень высокая
реакционная способность, он легко образует хлорид, фторид, оксалат, нитрат
и сульфат. Металл ярко горит в кислороде, образуя ThO2,
который получается также при прокаливании нитрата.
Протактиний
(от
греческого «протос», означающего «первый», и «актиний») называют материнским
веществом или отцом актиния, так как он образует актиний при a-распаде.
Протактиний открыт в 1918 независимо двумя группами исследователей. Одной
группой руководили О.Ган и Л.Мейтнер, другую возглавляли Ф.Содди и Дж.Кранстон.
Протактиний был обнаружен в природе как компонент урановых руд, около
70 мг Pa можно извлечь из 1 т урановой смолки. В ядерном реакторе при
облучении тория нейтронами 233Pa
образуется в сравнительно большом количестве. Протактиний очень реакционноспособен.
В степени окисления V он так энергично гидролизуется, что неустойчив в
кислом растворе и его необходимо стабилизировать в виде фторокомплекса.
Известны некоторые соединения Pa, например диоксид PaO2
и пентаоксид Pa2O5,
тетрагалогениды PaX4
и пентагалогениды PaX5,
а также нитрид PaN2.
Уран
открыт
М.Клапротом в 1789. Однако собственно металл был выделен лишь в 1841 Э.-М.Пелиго
при восстановлении хлорида металлическим калием. Уран не вызывал особого
интереса даже когда А.Беккерель открыл явление радиоактивности (1896),
пока в 1939 не была обнаружена возможность деления ядер. После изобретения
атомной бомбы уран стал важной военной продукцией.
|
Таблица 19б.
УРАНСОДЕРЖАЩИЕ МИНЕРАЛЫ
|
| Минерал |
Состав
|
Месторождение
|
| Уранинит |
UO2 (содержит
Th, La) |
Норвегия |
| Урановая
смолка |
UO2+x |
Республика
Конго |
| Эвксенит-поликраз |
(Y,Ca,Ce,U,Th)(Nb,Ta,Ti)2O6 |
Канада |
| Самарскит |
(Y,Ca,Fe,U,Th)(Nb,Ta)2O6 |
США |
| Давидит |
(Fe,Ce,U)(Ti,Fe,V,Cr)3(O,OH)7 |
Австралия |
| Коффинит |
USiO4 |
США |
| Карнотит |
K2(UO2)2(VO4)2ЧxH2O |
США |
| Тюямунит |
Ca(UO2)2(VO4)2ЧxH2O |
Узбекистан |
| Отенит |
Ca(UO2)2(PO4)2ЧxH2O |
Франция |
| Торбернит |
Cu(UO2)2(PO4)2ЧxH2O |
Германия |
| Уранофан |
Ca(UO2)2Si2O7ЧxH2O |
Республика
Конго |
Уран
встречается в разных рудах, наиболее важные из них уранинит, урановая
смолка (разновидность уранинита) и карнотит (см.
табл. 19б).
Руды переводят в гексафторид, обрабатывают аммиаком до получения диураната
аммония, прокаливают до оксида и затем из оксида выделяют чистый металл
(см. также
УРАНОВАЯ ПРОМЫШЛЕННОСТЬ).
Для урана известно 17 изотопов (с учетом
ядерных изомеров), три из которых являются природными: 238U
(99,275%), 235U
(0,720%) и 234U
(0,005%). Все изотопы урана подвергаются радиоактивному распаду, из 238U
в результате 14-стадийного
процесса a-
и b-распада
получается 206Pb,
а 235U
распадается до 207Pb
за 11 стадий
(см. также
АТОМНОГО ЯДРА СТРОЕНИЕ).
Реакции
и соединения.
Уран реагирует со
многими элементами и соединениями, образуя различные соли. Он растворяется
в азотной кислоте, но кислоты-неокислители, такие, как H2SO4
и HCl, растворяют уран очень медленно. Металлический уран не взаимодействует
со щелочами, но в присутствии пероксидов происходит образование растворимых
в воде перуранатов. В реакции с водородом образуется пирофорное соединение
UH3,
из которого можно получать высокореакционноспособный порошкообразный металл.
Уран образует 4 стабильных оксида – UO2,
U2O5,
U3O8
и UO3.
Кроме того, известно о существовании монооксида, который в чистом виде,
однако, не получен. Уран реагирует со всеми галогенами, проявляя различные
степени окисления. Известно 6 фторидов урана. Тетрафторид урана получают
по реакции UO2
c HF:

При
фторировании UF4
газообразным фтором образуется гексафторид:

Из
тетрафторида урана при восстановлении алюминием получают трифторид урана:

Остальные
галогены в реакциях с ураном образуют UX3,
UX4,
UX5 и
UX6.
Среди других соединений урана известны также карбиды (UC, U2C3
и UC2),
нитриды (UN, UN2),
сульфиды (US,
US2)
и бориды (UB, UB4).
Применение.
Металлический
уран применяют как ядерное топливо для получения плутония, радиоизотопов,
производства атомной энергии, как экранирующий материал для g-излучателей
(например, 60Co),
взрывчатое вещество в атомных бомбах, пигмент стекольной и керамической
промышленности, в производстве ферроурана. Соединения урана используют
в фармацевтике, в изготовлении желтых урановых глазурей, пигментов, в
фотографии и химическом анализе.
ТРАНСУРАНОВЫЕ ЭЛЕМЕНТЫ
Как явствует из их названия, трансурановые элементы – это химические
элементы, которые располагаются за ураном в ряду актиноидов. Это элементы
от нептуния (атомный номер 93) до лоуренсия (атомный номер 103). Их синтезируют
в ядерных реакциях из урана или некоторых других тяжелых элементов. Поэтому
более корректно считать, что эти элементы были получены, а не открыты. Все
трансурановые элементы радиоактивны.
|
ТРАНСУРАНОВЫЕ
ЭЛЕМЕНТЫ
|
| Название |
Символ
|
Атомный номер
|
Массовое числоа
|
Известные изотопы
|
| Нептуний |
Np
|
93
|
237
|
229–241
|
| Плутоний |
Pu
|
94
|
244
|
232–246
|
| Америций |
Am
|
95
|
243
|
237–247
|
| Кюрий |
Cm
|
96
|
247
|
238–250
|
| Берклий |
Bk
|
97
|
247
|
243–250
|
| Калифорний |
Cf
|
98
|
251
|
242, 244–254
|
| Эйнштейний |
Es
|
99
|
252
|
246–256
|
| Фермий |
Fm
|
100
|
257
|
248–257
|
| Менделевий |
Md
|
101
|
258
|
255–258
|
| Нобелий |
No
|
102
|
259
|
251–259
|
| Лоуренсий |
Lr
|
103
|
260
|
256–260
|
| а
Массовое число наиболее
долгоживущего изотопа. |
Открытие
(получение).
Нептуний.
Первый из открытых трансурановых
элементов был назван в честь планеты Нептун. В виде изотопа 239Np
он был впервые получен Э.Макмилланом и Ф.Эйблсоном в 1940 в Калифорнийском
университете в Беркли при бомбардировке урана нейтронами. 237Np
с периодом полураспада 2,14Ч106
лет получают как побочный продукт при производстве плутония в ядерных
реакторах. Следовые количества нептуния обнаружены в природе как результат
реакций трансмутации в урановых рудах, вызываемых нейтронами, которые
образуются в результате природного процесса деления урана.
Плутоний.
Названный в честь планеты
Плутон, плутоний в виде изотопа 238Pu
открыли Г.Сиборг, Э.Макмиллан, Дж.Кеннеди и А.Валь в конце 1940 в Калифорнийском
университете. Плутоний получается при бомбардировке урана дейтронами –
ядрами «тяжелого» водорода или атомами дейтерия. Благодаря совершенствованию
ядерной технологии получения 239Pu
из природного урана его производство исчисляется в килограммовых количествах.
Следы плутония обнаружены в природе как результат распада урана и его
облучения нейтронами. 239Pu
имеет период полураспада 24360 лет и является источником нейтронов. Он
успешно применяется как взрывчатый компонент ядерного оружия и как топливо
в ядерной энергетике.
Америций.
Четвертым открытым трансурановым
элементом, но третьим по расположению в ряду актиноидов, был америций,
названный в честь Америки. Он был открыт Г.Сиборгом, Р.Джеймсом, Л.Морганом
и А.Гиорсо в конце 1944 – начале 1945 в Металлургической лаборатории
Чикагского университета. 241Am
с периодом полураспада 470 лет получается при интенсивной нейтронной бомбардировке
плутония. Америций используют во многих химических исследованиях. В настоящее
время его получают в граммовых количествах.
Кюрий.
Названный в честь супругов
Марии Склодовской-Кюри и Пьера Кюри этот трансурановый элемент был идентифицирован
Г.Сиборгом, Р.Джеймсом и А.Гиорсо в 1944 в Металлургической лаборатории
Чикагского университета. При бомбардировке 239Pu
ионами гелия (a-частицами)
был получен кюрий-242. 242Cm
(период полураспада 162,5 сут) и 244Cm
(период полураспада 17,6 года) получаются и при нейтронной бомбардировке.
Берклий.
Берклий
– пятый из синтезированных трансурановых элементов – был открыт
С.Томпсоном, А.Гиорсо и Г.Сиборгом в конце 1949 в Беркли (шт. Калифорния),
в честь этого города и получил свое название. 243Bk
получается при бомбардировке 241Am
ионами гелия. Изотоп 249Bk
(период полураспада 314 сут) был выделен в весовых количествах. Элемент
может быть получен при длительной бомбардировке плутония нейтронами.
Калифорний.
Названный
так в честь одного из штатов США, этот элемент в виде 245Cf
является
шестым открытым трансурановым элементом. Он был получен С.Томсоном, К.Стритом,
А.Гиорсо и Г.Сиборгом в начале 1950 при бомбардировке микрограммовых количеств
242Cm
ионами гелия. Калифорний
в виде смеси изотопов 249Cf,
250Cf,
251Cf,
252Cf
выделен в весовых количествах после длительной нейтронной бомбардировки
плутония.
Эйнштейний.
Седьмой трансурановый
элемент был назван в честь А.Эйнштейна. Он был обнаружен вместе с другим
новым элементом (фермием) в Лос-Аламосской исследовательской лаборатории
в образцах, отобранных после экспериментального термоядерного взрыва в
1952. Сверхтяжелые изотопы урана, возникшие под действием на уран интенсивного
нейтронного потока, образовавшегося при этом взрыве, распадались на элемент-99
(эйнштейний) и элемент-100 (фермий) наряду с другими трансурановыми элементами.
Эйнштейний-253 (период полураспада 20 сут) открыли в конце 1952 Гиорсо
и его коллеги из Радиационной лаборатории Калифорнийского университета,
Аргоннской национальной лаборатории и Лос-Аламосской исследовательской
лаборатории. Сравнительно долгоживущий изотоп 254Es
(период полураспада 276 сут) получен нейтронной бомбардировкой, этот элемент
был выделен в весовых количествах. Наиболее долгоживущий изотоп 252Es
имеет период полураспада 471,7 сут.
Фермий.
Этот элемент открыт вместе
с эйнштейнием (см. выше).
Он был назван в честь Э.Ферми, физика, который руководил созданием первого
атомного реактора. 255Fm
(период полураспада 20 ч) открыли А.Гиорсо с сотр. в начале 1953 во время
экспериментов по обнаружению эйнштейния. Долгоживущим изотопом фермия
является 257Fm
(период полураспада около 80 сут).
Менделевий.
Менделевий – девятый
трансурановый элемент – назван в честь Д.И.Менделеева, русского
химика, открывшего периодический закон и предложившего классификацию элементов
в соответствии с увеличением их атомной массы. Впервые 256Md
(период полураспада около 1 ч)
был обнаружен А.Гиорсо, Б.Харви, Г.Шоппеном, С.Томсоном и Г.Сиборгом в
1955 при бомбардировке ничтожных количеств 253Es
ионами гелия в 152-см циклотроне в Беркли. Первая идентификация элемента
была удивительна, так как в опытах было получено всего 1 или 2 атома элемента.
258Md
был получен в 1967. Оказалось, что он имеет исключительно большой период
полураспада (~2
мес).
Нобелий.
Открыт А.Гиорсо, Т.Сиккеландом,
Дж.Уолтоном и Г.Сиборгом в апреле 1958. В линейном ускорителе тяжелых
ионов (Калифорнийский университет в Беркли) был получен изотоп с массовым
числом 254 и периодом полураспада 55 с. (В 1957 об открытии 102-го элемента
сообщила международная группа ученых, работавшая в Нобелевском институте
физики в Швеции. Воспроизвести их результаты не удалось ученым в Беркли
и в Дубне.)
Лоуренсий.
Открыт А.Гиорсо, Т.Сиккеландом,
А.Ларшем и Р.Латимером в Калифорнийском университете в апреле 1961. Элемент
был получен бомбардировкой калифорния ионами бора в линейном ускорителе
тяжелых ионов в Беркли. Полученный изотоп (либо 258Lr,
либо 259Lr)
имел период полураспада ~8
с. Это завершающий элемент ряда актиноидов.
Свойства.
Все трансурановые элементы
являются семейством химически сходных элементов актиноидного ряда и обладают
большим химическим сходством с лантаноидами. На основании изучения свойств
трансурановых элементов и их соединений установлено, что элементы в соответствии
с их электронной конфигурацией образуют две сходные группы. Внутренний
электронный слой четырнадцати 5f-электронов
заполняется по мере увеличения атомного номера актиноида, аналогичный
процесс происходит при застройке 4f-оболочки
лантаноидов. Все трансурановые элементы проявляют валентность (степень
окисления) III и образуют комплексные ионы с неорганическими и органическими
лигандами. Сульфаты, нитраты, хлориды и перхлораты элементов растворимы,
а трифториды и оксалаты нерастворимы в кислотах. Np, Pu, Am в водных растворах
проявляют степени окисления IV, V и VI, стабильность этих состояний в
сравнении со степенью окисления III уменьшается с ростом атомного номера.
Bk проявляет в водном растворе степени окисления IV и III. Растворы соединений
трансурановых элементов нередко окрашены. Например, ионы Np(III) окрашивают
раствор в бледнопурпуровый цвет, Pu(III) – в темнопурпуровый, Pu(IV)
– в зеленый цвет, а Am(III) – в розовый. Методом ионообменной
хроматографии изучены химические свойства многих соединений актиноидов.
Этот метод совместно с методикой сопоставления с лантаноидами способствовал
открытию и обнаружению элементов, расположенных после кюрия.
См. также
АТОМА СТРОЕНИЕ;
АТОМНОГО ЯДРА СТРОЕНИЕ.
ТРАНСАКТИНОИДНЫЕ ЭЛЕМЕНТЫ
Элементы
с атомными номерами 104 и далее называются трансактиноидными. Все они
получаются искусственно и являются радиоактивными. Об открытии 104 элемента
заявила группа советских ученых в 1964 и группа американских ученых в
1969. Открытие 105-го элемента было заявлено советской группой в 1968,
а американской – в 1970. О получении 106-го элемента было объявлено
советскими и американскими учеными в 1974, открытие 107-го заявлено советской
группой в 1976, а группой ученых из ФРГ в 1981. Та же группа из ФРГ заявила
об открытии 109-го элемента в 1982, а элемента 108 – в 1984. В настоящее
время для элементов 104–109 Генеральная ассамблея ИЮПАК утвердила
следующие названия и символы:
|
Атомный номер
|
Название
|
Символ
|
| 104 |
Резерфордий
|
Rf
|
| 105 |
Дубний
|
Db
|
| 106 |
Сиборгий
|
Sg
|
| 107 |
Борий
|
Bh
|
| 108 |
Хасий
|
Hs
|
| 109 |
Мейтнерий
|
Mt
|
ЛИТЕРАТУРА
Трифонов Д.Н. и др. Химические
элементы и нуклиды. М., 1980
Популярная
библиотека химических элементов,
кн. 1–2. М., 1983
Эмсли Дж. Элементы.
М., 1993
|


 жидкость
жидкость льшую
часть вещества звезд и межзвездной материи. С кислородом он образует наиболее
распространенное на земле вещество – воду, а совместно с углеродом
входит в состав каждого органического соединения. Водород – самый
легкий элемент с атомным номером 1; ядро протия – наиболее стабильного
изотопа водорода – состоит только из одного протона без нейтронов.
Всего у водорода три изотопа: 1) наиболее распространенный – протий
11H,
2) дейтерий – 21H
(или 21D)
часто называют «тяжелый» водород, 3) наименее распространенный изотоп
– тритий 31H
(или 31T)
является радиоактивным и поэтому в природе не встречается в сколько-нибудь
значительном количестве. Водород – бесцветный газ, без запаха, легко
возгорается при комнатной температуре, плохо растворяется в воде. Он находит
широкое применение в промышленности, например при гидрогенизации жиров
и масел.
льшую
часть вещества звезд и межзвездной материи. С кислородом он образует наиболее
распространенное на земле вещество – воду, а совместно с углеродом
входит в состав каждого органического соединения. Водород – самый
легкий элемент с атомным номером 1; ядро протия – наиболее стабильного
изотопа водорода – состоит только из одного протона без нейтронов.
Всего у водорода три изотопа: 1) наиболее распространенный – протий
11H,
2) дейтерий – 21H
(или 21D)
часто называют «тяжелый» водород, 3) наименее распространенный изотоп
– тритий 31H
(или 31T)
является радиоактивным и поэтому в природе не встречается в сколько-нибудь
значительном количестве. Водород – бесцветный газ, без запаха, легко
возгорается при комнатной температуре, плохо растворяется в воде. Он находит
широкое применение в промышленности, например при гидрогенизации жиров
и масел.

 .
Франций обладает большинством свойств, характерных для других щелочных
металлов, и отличается высокой электронодонорной активностью. Он образует
растворимые соли и гидроксид. Во всех соединениях франций проявляет степень
окисления I.
.
Франций обладает большинством свойств, характерных для других щелочных
металлов, и отличается высокой электронодонорной активностью. Он образует
растворимые соли и гидроксид. Во всех соединениях франций проявляет степень
окисления I.





















 H3O+
+ HSO4–
H3O+
+ HSO4–
 [Ag(S2O3)]–
+ Br–
[Ag(S2O3)]–
+ Br–





 [TiCl6]2–
[TiCl6]2–

 рами
тяжелых элементов в предыдущих семействах (например, Zr и Hf, Nb и Ta).
У вольфрама более сильная металлическая связь, чем у молибдена. Все рассматриваемые
металлы покрываются пассивирующей оксидной пленкой при хранении на воздухе
или в среде кислоты-окислителя. При удалении этой пленки химическим или
механическим способом химическая активность металлов существенно возрастает
(см.
электродные потенциалы в табл. 13). Доказательством этого является выделение
водорода при обработке хрома хлороводородной кислотой или даже паром.
рами
тяжелых элементов в предыдущих семействах (например, Zr и Hf, Nb и Ta).
У вольфрама более сильная металлическая связь, чем у молибдена. Все рассматриваемые
металлы покрываются пассивирующей оксидной пленкой при хранении на воздухе
или в среде кислоты-окислителя. При удалении этой пленки химическим или
механическим способом химическая активность металлов существенно возрастает
(см.
электродные потенциалы в табл. 13). Доказательством этого является выделение
водорода при обработке хрома хлороводородной кислотой или даже паром.


 .
.