
Межгалогенные
соединения
– соединения
различных галогенов друг с другом. Галоген с б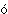 льшим
радиусом всегда имеет в таком соединении положительную степень окисления
(подвергается окислению), а с меньшим радиусом – более отрицательную
(подвергается восстановлению). Этот факт вытекает из общей тенденции изменения
активности в ряду галогенов. В табл. 8г приведены составы известных межгалогенных
соединений (А – галоген с более положительной степенью окисления). льшим
радиусом всегда имеет в таком соединении положительную степень окисления
(подвергается окислению), а с меньшим радиусом – более отрицательную
(подвергается восстановлению). Этот факт вытекает из общей тенденции изменения
активности в ряду галогенов. В табл. 8г приведены составы известных межгалогенных
соединений (А – галоген с более положительной степенью окисления).
|
Таблица 8г.
МЕЖГАЛОГЕННЫЕ СОЕДИНЕНИЯ
|
| АВ |
АВ3
|
АВ5
|
АВ7
|
| ClF |
ClF3
|
BrF5
|
IF7
|
| BrF |
BrF3
|
IF5
|
|
| ICl |
ICl3
|
|
|
| IBr |
|
|
|
Межгалогенные
соединения образуются прямым синтезом из элементов. Необычная для иода
степень окисления 7 реализуется в соединении IF7,
а другие галогены не могут координировать 7 атомов фтора. Прикладное значение
имеют BrF3
и ClF3
– жидкие вещества, химически аналогичные фтору, но более удобные
при фторировании. При этом более эффективен BrF3.
Поскольку трифториды – сильные
окислители и находятся в жидком состоянии, их используют как окислители
ракетного топлива.
Водородные
соединения.
Галогены реагируют
с водородом, образуя HX, причем со фтором и хлором реакция протекает со
взрывом при небольшой активации ее. Медленнее идет взаимодействие c Br2
и I2.
Для протекания реакции с водородом достаточно активировать небольшую долю
реагентов с помощью освещения или нагревания. Активированные частицы взаимодействуют
с неактивированными, образуя HX и новые активированные частицы, которые
продолжают процесс, а реакция двух активированных частиц по главной реакции
заканчивается образованием продукта. Например, образование HCl из H2
и Cl2:

Более
удобные методы получения галоиодоводородов, чем прямой синтез, дают, например,
следующие реакции:

В
газообразном состоянии HX являются ковалентными соединениями, однако в
водном растворе они (за исключением HF) становятся сильными кислотами.
Объясняется это тем, что молекулы воды эффективно оттягивают водород от
галогена. Все кислоты хорошо растворимы в воде благодаря гидратации:
HX
+ H2O
® H3O+
+ X–
HF
более склонен к комплексообразованию, чем другие галогеноводороды. Заряды
на H и F так велики, а эти атомы так малы, что происходит образование
HX-ассоциатов
типа полимеров состава (HF)x,
где x
і 3.
В таком растворе диссоциация под действием молекулы воды идет не более
чем на несколько процентов от общего количества ионов водорода. В отличие
от других галогеноводородов фтороводород активно реагирует с SiO2
и силикатами, выделяя газообразный
SiF4.
Поэтому водный раствор HF (плавиковая кислота) используют в травлении
стекла и хранят не в стеклянной, а в парафиновой или полиэтиленовой посуде.
Чистый HF кипит чуть ниже комнатной температуры (19,52°
С), поэтому его хранят в виде жидкости в стальных цилиндрах. Водный раствор
HCl называют соляной кислотой. Насыщенный раствор, содержащий 36% (масс.)
HCl, широко используют в химической промышленности и лабораториях
(см. также
ВОДОРОД).
назад
дальше
|


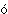 льшим
радиусом всегда имеет в таком соединении положительную степень окисления
(подвергается окислению), а с меньшим радиусом – более отрицательную
(подвергается восстановлению). Этот факт вытекает из общей тенденции изменения
активности в ряду галогенов. В табл. 8г приведены составы известных межгалогенных
соединений (А – галоген с более положительной степенью окисления).
льшим
радиусом всегда имеет в таком соединении положительную степень окисления
(подвергается окислению), а с меньшим радиусом – более отрицательную
(подвергается восстановлению). Этот факт вытекает из общей тенденции изменения
активности в ряду галогенов. В табл. 8г приведены составы известных межгалогенных
соединений (А – галоген с более положительной степенью окисления).

