
Неон
впервые был выделен У.Рамзаем
и М.Траверсом в 1898 при фракционном разделении воздуха. Из 44 т жидкого
воздуха можно получить всего около 450 г неона. В газоразрядной трубке
возбужденный неон имеет приятный красно-оранжевый или розовый цвет. Существенные
количества неона используются в неоновой рекламе. При смешении неона с
парами ртути можно получать различную окраску.
Аргон
был открыт как инертный
газ в атмосфере в 1894 Дж.Рэлеем, который обнаружил, что атмосферный азот
на 0,5% тяжелее, чем полученный химическим путем. Разница объяснялась
присутствием ничтожного количества более тяжелых инертных газов, преимущественно
аргона. Этот элемент был первым из инертных газов, обнаруженных в природе
на нашей планете. Содержание аргона в атмосфере составляет 0,93%(об.),
причем его несколько больше над поверхностью больших водоемов, чем над
сушей, так как азот и кислород более растворимы в воде. В электротехнической
промышленности ежемесячно расходуется несколько тысяч кубических метров
аргона для создания инертной среды в лампах накаливания: аргоновая среда
позволяет снизить скорость испарения вольфрамовой нити и предотвращает
ее окисление.
Криптон
был открыт У.Рамзаем
и М.Траверсом в 1898 при анализе остатков воздуха после разделения. Необычное
свойство газа заключается в возможности создания при его возбуждении интенсивной
вспышки, длящейся только 0,00002 с. Поэтому его используют для высокоскоростной
фотографии.
Ксенон
и радон. Ксенон,
тяжелый благородный газ со стабильным ядром, был открыт У.Рамзаем и М.Траверсом
в 1898. Радон, самый тяжелый из благородных газов, был открыт в 1900 Э.Резерфордом
(220Rn)
и Ф.Дорном и А.Дебьёрном (222Rn),
а в 1903 Ф.Гизель и Дебьёрн открыли 219Rn.
Атом радона имеет три короткоживущих изотопа 222, 220 и 219 и отличается
чрезвычайно нестабильной структурой ядра; он испускает a-частицы,
образуя полоний. Радий распадается до радона, и поэтому все минералы,
содержащие радий, содержат радон. Для выделения радона из таких минералов
требуется сильное нагревание. Радон из радия собирают в ловушки и размещают
в золотых ампулах для лечения больных раком. g-Излучение
радона идентично излучению радия, и раковые больные получают лечение с
помощью ампулы, вшитой в участок тела вблизи злокачественной опухоли.
ВОДОРОД
Водород
– наиболее распространенный элемент во Вселенной. Он соcтавляет
б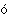 льшую
часть вещества звезд и межзвездной материи. С кислородом он образует наиболее
распространенное на земле вещество – воду, а совместно с углеродом
входит в состав каждого органического соединения. Водород – самый
легкий элемент с атомным номером 1; ядро протия – наиболее стабильного
изотопа водорода – состоит только из одного протона без нейтронов.
Всего у водорода три изотопа: 1) наиболее распространенный – протий
11H,
2) дейтерий – 21H
(или 21D)
часто называют «тяжелый» водород, 3) наименее распространенный изотоп
– тритий 31H
(или 31T)
является радиоактивным и поэтому в природе не встречается в сколько-нибудь
значительном количестве. Водород – бесцветный газ, без запаха, легко
возгорается при комнатной температуре, плохо растворяется в воде. Он находит
широкое применение в промышленности, например при гидрогенизации жиров
и масел. льшую
часть вещества звезд и межзвездной материи. С кислородом он образует наиболее
распространенное на земле вещество – воду, а совместно с углеродом
входит в состав каждого органического соединения. Водород – самый
легкий элемент с атомным номером 1; ядро протия – наиболее стабильного
изотопа водорода – состоит только из одного протона без нейтронов.
Всего у водорода три изотопа: 1) наиболее распространенный – протий
11H,
2) дейтерий – 21H
(или 21D)
часто называют «тяжелый» водород, 3) наименее распространенный изотоп
– тритий 31H
(или 31T)
является радиоактивным и поэтому в природе не встречается в сколько-нибудь
значительном количестве. Водород – бесцветный газ, без запаха, легко
возгорается при комнатной температуре, плохо растворяется в воде. Он находит
широкое применение в промышленности, например при гидрогенизации жиров
и масел.
Водород занимает особое положение в
периодической системе (см.
рис. 1), так как его электронная структура состоит всего из одного электрона.
Способность отдавать его, образуя ионную связь, роднит водород со щелочными
металлами, и его располагают в верху подгруппы щелочных металлов (подгруппа
IА).
Но водород может и принимать один электрон, проявляя отрицательную степень
окисления, как галогены (фтор, хлор и др.), поэтому его иногда называют
«псевдогалоген» и размещают в верху подгруппы галогенов (подгруппа VIIA).
См. также
ВОДОРОД.
назад
дальше
|


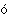 льшую
часть вещества звезд и межзвездной материи. С кислородом он образует наиболее
распространенное на земле вещество – воду, а совместно с углеродом
входит в состав каждого органического соединения. Водород – самый
легкий элемент с атомным номером 1; ядро протия – наиболее стабильного
изотопа водорода – состоит только из одного протона без нейтронов.
Всего у водорода три изотопа: 1) наиболее распространенный – протий
11H,
2) дейтерий – 21H
(или 21D)
часто называют «тяжелый» водород, 3) наименее распространенный изотоп
– тритий 31H
(или 31T)
является радиоактивным и поэтому в природе не встречается в сколько-нибудь
значительном количестве. Водород – бесцветный газ, без запаха, легко
возгорается при комнатной температуре, плохо растворяется в воде. Он находит
широкое применение в промышленности, например при гидрогенизации жиров
и масел.
льшую
часть вещества звезд и межзвездной материи. С кислородом он образует наиболее
распространенное на земле вещество – воду, а совместно с углеродом
входит в состав каждого органического соединения. Водород – самый
легкий элемент с атомным номером 1; ядро протия – наиболее стабильного
изотопа водорода – состоит только из одного протона без нейтронов.
Всего у водорода три изотопа: 1) наиболее распространенный – протий
11H,
2) дейтерий – 21H
(или 21D)
часто называют «тяжелый» водород, 3) наименее распространенный изотоп
– тритий 31H
(или 31T)
является радиоактивным и поэтому в природе не встречается в сколько-нибудь
значительном количестве. Водород – бесцветный газ, без запаха, легко
возгорается при комнатной температуре, плохо растворяется в воде. Он находит
широкое применение в промышленности, например при гидрогенизации жиров
и масел.