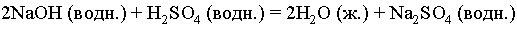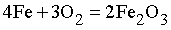Сбалансированные уравнения.
Реакцию между серной кислотой и гидроксидом натрия с образованием сульфата натрия и воды можно записать в виде NaOH + H2SO4 = H2O + Na2SO4. В действительности это уравнение не точное, поскольку число атомов одного и того же элемента в обоих частях равенства должно быть одинаковым, здесь же в левой части один атом натрия, а справа – два. Чтобы уравнять число атомов Na, перед NaOH нужно поставить коэффициент 2; аналогичным образом следует уравнять число атомов водорода и кислорода. В результате уравнение примет вид
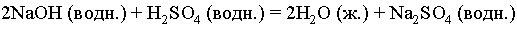
Подобные процедуры необходимо проводить до того, как уравнение будет использоваться для каких-либо вычислений.
Ионные уравнения.
Многие вещества в растворе диссоциируют на ионы, которые могут вступать в химические реакции. В качестве примера рассмотрим приведенную выше реакцию между растворенными в воде гидроксидом натрия и серной кислотой. Реакция, записанная в ионной форме, будет иметь вид

Ионизация воды здесь не показана. Отметим, что число ионов натрия и сульфат-ионов не изменяется, взаимодействуют только гидроксильные ионы и ионы водорода, поэтому суммарную реакцию можно записать в виде

или еще проще

Массовые соотношения.
Зная химическую формулу соединения и атомные массы, можно найти соотношения между массами элементов, входящих в состав соединения. Рассмотрим соединение Fe2O3 – оксид железа(III), обычную ржавчину. Найдем в периодической таблице атомные массы элементов и сложим их:

Доля железа в оксиде железа(III) составляет 111,6940/159,6922 = 0,6994, или 69,94%. 159,6922 – это мол. масса оксида железа(III). См. также МОЛЕКУЛЯРНАЯ МАССА.
Распространив этот принцип на химические уравнения, можно рассчитать, какое количество каждого из реагентов необходимо взять для того, чтобы по завершении реакции ни один из них не остался неизрасходованным, а также оценить, сколько разных продуктов образуется в ходе реакции. Так, в реакции окисления железа
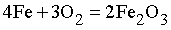
4Ч55,8470 = 223,3880 г железа взаимодействуют с 6Ч15,9994 = 95,9964 г кислорода, образуя 319,3844 г оксида железа(III). Зная количество железа, всегда можно рассчитать массу образовавшегося из него оксида.
назад
дальше
|