
Положительно заряженные ионы.
Названия этих ионов образуются следующим образом: после слова ион указывают название элемента и римскими цифрами – степень его окисления. Например, Cu2+ – ион меди(II), Cu+ – ион меди(I). Названия некоторых положительных ионов оканчиваются на -оний: аммоний, NH4+; гидроксоний, H3O+.
Отрицательно заряженные ионы.
Названия одноатомных отрицательно заряженных ионов (и соответственно солей), полученных из не содержащих кислорода кислот, оканчиваются на -ид: хлорид-ион, Cl–; бромид-ион, Br–. Названия ионов (и соответственно солей), полученных из кислородсодержащих кислот, в которых центральный элемент имеет меньшую степень окисления, оканчиваются на -ит: сульфит, SO32–; нитрит, NO2–; фосфит, PO33–; а б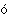 льшую – на -ат: сульфат, SO42–; нитрат, NO3–; фосфат, РО43–. Названия ионов, полученных из частично нейтрализованных кислот, образуются прибавлением к названию иона слова кислый либо приставок гидро- или би-: гидрокарбонат (бикарбонат), HCO3–; кислый сульфат, HSO4–. льшую – на -ат: сульфат, SO42–; нитрат, NO3–; фосфат, РО43–. Названия ионов, полученных из частично нейтрализованных кислот, образуются прибавлением к названию иона слова кислый либо приставок гидро- или би-: гидрокарбонат (бикарбонат), HCO3–; кислый сульфат, HSO4–.
Соли и ковалентные соединения.
Для солей и ковалентных соединений используют названия ионов, которые в них входят: хлорид натрия, NaCl; гидроксид натрия, NaOH. Если элемент может иметь несколько степеней окисления, то после его названия римскими цифрами указывают степень окисления в данном соединении: сульфат железа(II), FeSO4; сульфат железа(III), Fe2(SO4)3. Если соединение образуют два неметалла, то для указания числа их атомов используют приставки ди-, три-, тетра-, пента- и т.д. Например, дисульфид углерода, CS2; пентахлорид фосфора, PCl5, и т.д.
назад
дальше
|


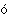 льшую – на -ат: сульфат, SO42–; нитрат, NO3–; фосфат, РО43–. Названия ионов, полученных из частично нейтрализованных кислот, образуются прибавлением к названию иона слова кислый либо приставок гидро- или би-: гидрокарбонат (бикарбонат), HCO3–; кислый сульфат, HSO4–.
льшую – на -ат: сульфат, SO42–; нитрат, NO3–; фосфат, РО43–. Названия ионов, полученных из частично нейтрализованных кислот, образуются прибавлением к названию иона слова кислый либо приставок гидро- или би-: гидрокарбонат (бикарбонат), HCO3–; кислый сульфат, HSO4–.