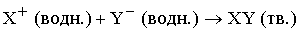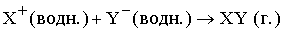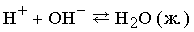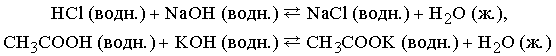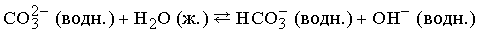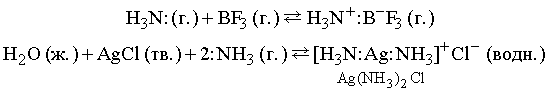Типы реакций.
Реакции можно классифицировать, используя несколько схем, и каждая из них по-своему удобна. Здесь реакции разделены на три типа: ионные, в ходе которых ионы удаляются из зоны реакции путем образования нерастворимого, газообразного или ковалентно связанного продукта; окислительно-восстановительные, в которых происходит перемещение электронов; реакции (в том числе реакции между кислотой Льюиса и основанием Льюиса), сопровождающиеся перераспределением обобществленных электронов.
Ионные реакции.
Простые ионные реакции без переноса электронов происходят, когда один из продуктов нерастворим (газ или твердое вещество) или является ковалентно связанным веществом, остающимся в растворе. Ионную реакцию, продукт которой – нерастворимое твердое вещество, можно представить в виде
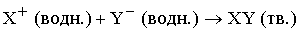
Сами ионы в ходе реакции не претерпели никаких изменений, но теперь они прочно удерживаются в кристаллической решетке.
Для предсказания хода таких реакций важно знать растворимость участвующих в них веществ. Например, хлорид серебра плохо растворяется в воде, и можно сделать вывод, что реакция

хотя
и обратима, но равновесие сильно сдвинуто вправо. (Эту реакцию используют для
обнаружения ионов хлора или серебра в растворе, а также для их количественного
определения.
См. также
ХИМИЯ АНАЛИТИЧЕСКАЯ.) Ионы
серебра могут находиться в составе любого из растворимых соединений: в виде
нитрата, сульфата, ацетата и т.д.; ионы хлора могут быть компонентами таких
солей, как соли натрия, калия, бария или алюминия. Таким образом, приведенное
выше уравнение можно рассматривать как обобщенное представление реакции обменного
разложения, когда два реагента разлагаются и обмениваются своими составляющими.
Например, это могут быть такие реакции:

При образовании газообразного продукта вещество тоже выводится из зоны реакции. Этот тип ионной реакции можно представить в следующем виде:
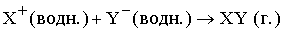
В данном случае ионы перестают существовать – из них образуются молекулы. В качестве примера можно привести растворение карбоната в кислом растворе. Вместе с образующимся газообразным диоксидом углерода из реакционной смеси уходят углерод и кислород:

Реакции, в которых образуется ковалентно связанный (недиссоциирующий) продукт, можно представить следующим образом:

К этому типу относятся реакции нейтрализации. Когда соединение, которое диссоциирует с образованием ионов водорода (кислота), взаимодействует с основанием (источником гидроксильных ионов), образуется вода. В молекуле воды все атомы соединены ковалентными связями, поэтому реакция идет практически до конца (ее константа равновесия равна 10–14). Реакцию нейтрализации можно записать в виде
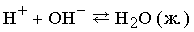
Приведем примеры реакций нейтрализации с участием сильной (HCl) и слабой (CH3COOH) кислот:
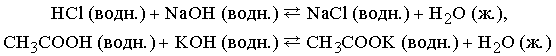
Сильные кислоты практически полностью диссоциируют в воде, высвобождая ионы водорода, слабые диссоциируют незначительно. Плохо диссоциируют и слабые основания.
Ниже перечислены наиболее распространенные кислоты и основания. Отметим, что некоторые соединения обладают как кислотными, так и основными свойствами. Их называют амфотерными.
|
Сильные кислоты
|
Слабые кислоты
|
Сильные основания
|
Слабые основания
|
|
HI
|
HSO4–
|
NaOH
|
NH3
|
|
HCl
|
HPO42–
|
KOH
|
CH3COO–
|
|
HBr
|
H2S
|
Ba(OH)2
|
HPO42–
|
|
HNO3
|
CH3COOH
|
Ca(OH)2
|
CO32–
|
|
H3PO4
|
HClO
|
AgOH
|
HCO3–
|
|
H2SO4
|
H2CO3
|
S2–
|
HS–
|
|
HClO4
|
HCO3–
|
PO43–
|
|
Слабые основания, представленные в таблице, не содержат ионов ОН–. Эти ионы образуются при взаимодействии с водой:
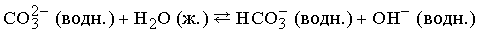
Поэтому раствор карбоната щелочной.
Более общее определение кислот и оснований, которое используется и в случае неводных систем, например газов, было дано американским физикохимиком Г.Льюисом. Взаимодействие между льюисовыми кислотами и основаниями – это реакция между донором электронной пары, за счет которой образуется ковалентная связь (основание Льюиса), и акцептором этой пары (кислота Льюиса). В качестве примера можно привести следующие реакции:
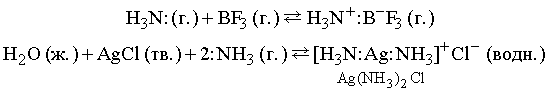
назад
дальше
|