
Молекулярный азот.
Из определений плотности газа установлено, что молекула азота двухатомна, т.е. молекулярная формула азота имеет вид NєN (или N2). У двух атомов азота три внешних 2p-электрона каждого атома образуют тройную связь :N:::N:, формируя электронные пары. Измеренное межатомное расстояние N–N равно 1,095 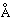 . Как и в случае с водородом (см. ВОДОРОД), существуют молекулы азота с различным спином ядра – симметричные и антисимметричные. При обычной температуре соотношение симметричной и антисимметричной форм равно 2:1. В твердом состоянии известны две модификации азота: a – кубическая и b – гексагональная с температурой перехода a ® b –237,39° С. Модификация b плавится при –209,96° С и кипит при –195,78° C при 1 атм (см. табл. 1). . Как и в случае с водородом (см. ВОДОРОД), существуют молекулы азота с различным спином ядра – симметричные и антисимметричные. При обычной температуре соотношение симметричной и антисимметричной форм равно 2:1. В твердом состоянии известны две модификации азота: a – кубическая и b – гексагональная с температурой перехода a ® b –237,39° С. Модификация b плавится при –209,96° С и кипит при –195,78° C при 1 атм (см. табл. 1).
Энергия диссоциации моля (28,016 г или 6,023Ч1023 молекул) молекулярного азота на атомы (N2 2N) равна примерно –225 ккал. Поэтому атомарный азот может образовываться при тихом электрическом разряде и химически более активен, чем молекулярный азот. 2N) равна примерно –225 ккал. Поэтому атомарный азот может образовываться при тихом электрическом разряде и химически более активен, чем молекулярный азот.
Получение и применение.
Способ получения элементного азота зависит от требуемой его чистоты. В огромных количествах азот получают для синтеза аммиака, при этом допустимы небольшие примеси благородных газов.
Азот из атмосферы.
Экономически выделение азота из атмосферы обусловлено дешевизной метода сжижения очищенного воздуха (пары воды, CO2, пыль, другие примеси удалены). Последовательные циклы сжатия, охлаждения и расширения такого воздуха приводят к его сжижению. Жидкий воздух подвергают фракционной перегонке при медленном подъеме температуры. Первыми выделяются благородные газы, затем азот, и остается жидкий кислород. Очистка достигается многократностью процессов фракционирования. Таким методом производят многие миллионы тонн азота ежегодно, преимущественно для синтеза аммиака, который является исходным сырьем в технологии производства различных азотсодержащих соединений для промышленности и сельского хозяйства. Кроме того, очищенную азотную атмосферу часто используют, когда недопустимо присутствие кислорода.
Лабораторные способы.
Азот в небольших количествах можно получать в лаборатории разными способами, окисляя аммиак или ион аммония, например:

Очень удобен процесс окисления иона аммония нитрит-ионом:

Известны и другие способы – разложение азидов при нагревании, разложение аммиака оксидом меди(II), взаимодействие нитритов с сульфаминовой кислотой или мочевиной:

При каталитическом разложении аммиака при высокой температуре тоже можно получить азот:

назад
дальше
|


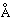 . Как и в случае с водородом
. Как и в случае с водородом 2N) равна примерно –225 ккал. Поэтому атомарный азот может образовываться при тихом электрическом разряде и химически более активен, чем молекулярный азот.
2N) равна примерно –225 ккал. Поэтому атомарный азот может образовываться при тихом электрическом разряде и химически более активен, чем молекулярный азот.



