

  
|
 |

Кипение жидкостей.
При кипении жидкости в открытом сосуде давление внутри пузырьков пара, образующихся в жидкости, должно быть по меньшей мере равно атмосферному давлению – иначе пузырьки просто будут схлопываться. Следовательно, в точке кипения давление паров жидкости равно атмосферному. На достаточно большой высоте температура кипения жидкости ниже, чем на уровне моря, поскольку барометрическое давление понижается с высотой. Так, температура кипения воды на высоте 4000 м составляет лишь около 85° С, тогда как на уровне моря она равна 100° С.
Кипение – это интенсивное испарение жидкости, происходящее не только с поверхности, но и во всем ее объеме, внутрь образующихся пузырьков пара. Чтобы перейти из жидкости в пар, молекулы должны приобрести энергию, необходимую для преодоления сил притяжения, удерживающих их в жидкости. Например, для испарения 1 г воды при температуре 100 ° С и давлении, соответствующем атмосферному давлению на уровне моря, требуется затратить 2258 Дж, из которых 1880 идут на отделение молекул от жидкости, а остальные – на работу по увеличению объема, занимаемого системой, против сил атмосферного давления (1 г водяных паров при 100° С и нормальном давлении занимает объем 1,673 см3, тогда как 1 г воды при тех же условиях – лишь 1,04 см3).
Температура кипения раствора нелетучего вещества, как правило, выше, чем чистого растворителя. Поскольку жидкость закипает, когда давление ее паров становится равным атмосферному, указанная закономерность означает, что давление паров раствора нелетучего вещества при данной температуре ниже, чем у чистого растворителя.
Затвердевание жидкостей.
Обычно при затвердевании жидкостей их объем несколько уменьшается (примерно на 10%), хотя существуют и исключения из этого правила. Например, вода, галлий и висмут при затвердевании расширяются, так что затвердевшее вещество плавает на поверхности жидкости. Поведение жидкостей вблизи температуры затвердевания может обнаруживать и другие аномалии, например при повышении температуры в интервале от 0 до 4° С вода сжимается. Чтобы объяснить эти экспериментальные факты, рассмотрим сначала переход от жидкого состояния к твердому для «нормальных» веществ, например алюминия. Как показывает рентгеноструктурный анализ, алюминий кристаллизуется с образованием гранецентрированной кубической решетки (рис. 6), в которой каждый атом окружен двенадцатью ближайшими соседями, находящимися от него на расстоянии 2,86 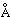 (2,86Ч10–8 см). Если атомы считать сферами, то такое расположение соответствует наиболее плотной их упаковке («плотноупакованная» структура). В алюминии, находящемся в жидком состоянии, дальний порядок отсутствует, однако какой-то ближний порядок все же остается. По данным рентгеновской дифракции каждый атом в нем окружен 10–11 ближайшими соседями, расположенными на расстоянии 2,96 (2,86Ч10–8 см). Если атомы считать сферами, то такое расположение соответствует наиболее плотной их упаковке («плотноупакованная» структура). В алюминии, находящемся в жидком состоянии, дальний порядок отсутствует, однако какой-то ближний порядок все же остается. По данным рентгеновской дифракции каждый атом в нем окружен 10–11 ближайшими соседями, расположенными на расстоянии 2,96 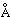 от него, т.е. структура жидкого алюминия вблизи температуры затвердевания сходна со структурой твердого алюминия, но несколько более «рыхлая». Для воды, галлия и висмута наблюдается обратная картина: вблизи температуры затвердевания более «рыхлой» является их структура не в жидком, а в твердом состоянии. Ответ на вопрос о причинах такой аномалии следует искать в особенностях строения их молекул и связей между ними в разных агрегатных состояниях. Рассмотрим, например, воду и лед. Оба они построены из одних и тех же молекул, которые состоят из дважды ионизованных отрицательных ионов кислорода (О2–) и двух однократно ионизованных положительных ионов водорода (H+). В молекуле воды эти три иона образуют треугольник с двумя протонами в основании и кислородом в вершине (соответственно два малых кружка и один большой на рис. 7); угол между связями O–H равен 104°. В структуре льда молекулы H2O расположены так, что каждый атом кислорода находится в окружении четырех водородных атомов, располагающихся в вершинах тетраэдра. Это обеспечивает максимальный выигрыш в энергии благодаря притяжению между положительными и отрицательными ионами, но структура становится значительно более «рыхлой». При плавлении льда такая довольно неэкономичная упаковка молекул H2O постепенно сменяется более плотной, и в интервале от 0 до 4° С объем вещества постепенно уменьшается. Рыхлая структура твердых галлия и висмута тоже обусловливается особенностями взаимодействий между атомами, однако характер этих связей гораздо сложнее, чем у льда. от него, т.е. структура жидкого алюминия вблизи температуры затвердевания сходна со структурой твердого алюминия, но несколько более «рыхлая». Для воды, галлия и висмута наблюдается обратная картина: вблизи температуры затвердевания более «рыхлой» является их структура не в жидком, а в твердом состоянии. Ответ на вопрос о причинах такой аномалии следует искать в особенностях строения их молекул и связей между ними в разных агрегатных состояниях. Рассмотрим, например, воду и лед. Оба они построены из одних и тех же молекул, которые состоят из дважды ионизованных отрицательных ионов кислорода (О2–) и двух однократно ионизованных положительных ионов водорода (H+). В молекуле воды эти три иона образуют треугольник с двумя протонами в основании и кислородом в вершине (соответственно два малых кружка и один большой на рис. 7); угол между связями O–H равен 104°. В структуре льда молекулы H2O расположены так, что каждый атом кислорода находится в окружении четырех водородных атомов, располагающихся в вершинах тетраэдра. Это обеспечивает максимальный выигрыш в энергии благодаря притяжению между положительными и отрицательными ионами, но структура становится значительно более «рыхлой». При плавлении льда такая довольно неэкономичная упаковка молекул H2O постепенно сменяется более плотной, и в интервале от 0 до 4° С объем вещества постепенно уменьшается. Рыхлая структура твердых галлия и висмута тоже обусловливается особенностями взаимодействий между атомами, однако характер этих связей гораздо сложнее, чем у льда.
 (8.17 Кб) (8.17 Кб)
 (14.00 Кб) (14.00 Кб)
назад
дальше
|
 |
 |



|


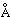 (2,86Ч10–8 см). Если атомы считать сферами, то такое расположение соответствует наиболее плотной их упаковке («плотноупакованная» структура). В алюминии, находящемся в жидком состоянии, дальний порядок отсутствует, однако какой-то ближний порядок все же остается. По данным рентгеновской дифракции каждый атом в нем окружен 10–11 ближайшими соседями, расположенными на расстоянии 2,96
(2,86Ч10–8 см). Если атомы считать сферами, то такое расположение соответствует наиболее плотной их упаковке («плотноупакованная» структура). В алюминии, находящемся в жидком состоянии, дальний порядок отсутствует, однако какой-то ближний порядок все же остается. По данным рентгеновской дифракции каждый атом в нем окружен 10–11 ближайшими соседями, расположенными на расстоянии 2,96  (8.17 Кб)
(8.17 Кб) (14.00 Кб)
(14.00 Кб)