

  
|
 |

Молярность
(M или моль/л) – число молей растворенного веществ, содержащихся в 1 л раствора.
Моляльность
(м) – число молей растворенного вещества, содержащихся в 1000 г растворителя.
Нормальность
(н.) – число химических эквивалентов растворенного вещества, содержащихся в 1 л раствора.
Мольная доля
(безразмерная величина) – число молей данного компонента, отнесенное к общему числу молей растворенного вещества и растворителя. (Мольный процент – мольная доля, умноженная на 100.)
Наиболее распространенная единица – молярность, но при ее расчете следует учитывать некоторые неоднозначности. Например, чтобы получить 1M раствор данного вещества, растворяют в заведомо небольшом количестве воды точную его навеску, равную мол. массе в граммах, и доводят объем раствора до 1 л. Количество воды, необходимое для приготовления данного раствора, может слегка различаться в зависимости от температуры и давления. Поэтому два одномолярных раствора, приготовленных в разных условиях, в действительности имеют не совсем одинаковые концентрации. Моляльность вычисляется исходя из определенной массы растворителя (1000 г), которая не зависит от температуры и давления. В лабораторной практике гораздо удобнее отмеривать определенные объемы жидкостей (для этого существуют бюретки, пипетки, мерные колбы), чем взвешивать их, поэтому в научной литературе концентрации чаще выражают в молях, а моляльность обычно применяют только при особо точных измерениях.
Нормальность используется для упрощения расчетов. Как мы уже говорили, вещества взаимодействуют друг с другом в количествах, соответствующих их эквивалентам. Приготовив растворы разных веществ одинаковой нормальности и взяв равные их объемы, мы можем быть уверены в том, что они содержат одно и то же количество эквивалентов.
В тех случаях, когда трудно (или нет необходимости) делать различие между растворителем и растворенным веществом, концентрацию измеряют в мольных долях. Мольные доли, как и моляльности, не зависят от температуры и давления.
Зная плотности растворенного вещества и раствора, можно пересчитать одну концентрацию в другую: молярность в моляльность, мольную долю и наоборот. Для разбавленных растворов данного растворенного вещества и растворителя эти три величины пропорциональны друг другу.
Растворимость
данного вещества – это его способность образовывать растворы с другими веществами. Количественно растворимость газа, жидкости или твердого тела измеряется концентрацией их насыщенного раствора при данной температуре. Это важная характеристика вещества, помогающая понять его природу, а также влиять на ход реакций, в которых это вещество участвует.
Газы.
В отсутствие химического взаимодействия газы смешиваются друг с другом в любых пропорциях, и в этом случае говорить о насыщении нет смысла. Однако при растворении газа в жидкости существует некая предельная концентрация, зависящая от давления и температуры. Растворимость газов в некоторых жидкостях коррелирует с их способностью к сжижению. Наиболее легко сжижаемые газы, например NH3, HCl, SO2, более растворимы, чем трудно сжижаемые газы, например O2, H2 и He. При наличии химического взаимодействия между растворителем и газом (например, между водой и NH3 или HCl) растворимость увеличивается. Растворимость данного газа изменяется с природой растворителя, однако порядок, в котором располагаются газы в соответствии с увеличением их растворимости, остается примерно одинаковым для разных растворителей.
Процесс растворения подчиняется принципу Ле Шателье (1884): если на систему, находящуюся в равновесии, оказывается какое-либо воздействие, то в результате протекающих в ней процессов равновесие сместится в таком направлении, что оказанное воздействие уменьшится. Растворение газов в жидкостях обычно сопровождается выделением тепла. При этом, в соответствии с принципом Ле Шателье, растворимость газов уменьшается. Это уменьшение тем заметнее, чем выше растворимость газов: такие газы имеют и б 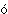 льшую теплоту растворения. «Мягкий» вкус кипяченой или дистиллированной воды объясняется отсутствием в ней воздуха, поскольку его растворимость при высокой температуре весьма мала. льшую теплоту растворения. «Мягкий» вкус кипяченой или дистиллированной воды объясняется отсутствием в ней воздуха, поскольку его растворимость при высокой температуре весьма мала.
С ростом давления растворимость газов увеличивается. Согласно закону Генри (1803), масса газа, который может раствориться в данном объеме жидкости при постоянной температуре, пропорциональна его давлению. Это свойство используется для приготовления газированных напитков. Углекислый газ растворяют в жидкости при давлении 3–4 атм.; в этих условиях в данном объеме может раствориться в 3–4 раза больше газа (по массе), чем при 1 атм. Когда емкость с такой жидкостью открывают, давление в ней падает, и часть растворенного газа выделяется в виде пузырьков. Аналогичный эффект наблюдается при открывании бутылки шампанского или выходе на поверхность подземных вод, насыщенных на большой глубине углекислым газом.
При растворении в одной жидкости смеси газов растворимость каждого из них остается такой же, как и в отсутствие других компонентов при таком же давлении, как в случае смеси (закон Дальтона).
назад
дальше
|
 |
 |



|


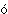 льшую теплоту растворения. «Мягкий» вкус кипяченой или дистиллированной воды объясняется отсутствием в ней воздуха, поскольку его растворимость при высокой температуре весьма мала.
льшую теплоту растворения. «Мягкий» вкус кипяченой или дистиллированной воды объясняется отсутствием в ней воздуха, поскольку его растворимость при высокой температуре весьма мала.