

  
|
 |

МОЛЕКУЛ СТРОЕНИЕ
(молекулярная структура), взаимное расположение атомов в молекулах. В ходе химических реакций происходит перегруппировка атомов в молекулах реагентов и образуются новые соединения. Поэтому одна из фундаментальных химических проблем состоит в выяснении расположения атомов в исходных соединениях и характера изменений при образовании из них других соединений.
Первые представления о структуре молекул основывались на анализе химического поведения вещества. Эти представления усложнялись по мере накопления знаний о химических свойствах веществ. Применение основных законов химии позволяло определить число и тип атомов, из которых состоит молекула данного соединения; эта информация содержится в химической формуле. Со временем химики осознали, что одной химической формулы недостаточно для точной характеристики молекулы, поскольку существуют молекулы-изомеры, имеющие одинаковые химические формулы, но разные свойства. Этот факт навел ученых на мысль, что атомы в молекуле должны иметь определенную топологию, стабилизируемую связями между ними. Впервые эту идею высказал в 1858 немецкий химик Ф.Кекуле. Согласно его представлениям, молекулу можно изобразить с помощью структурной формулы, в которой указаны не только сами атомы, но и связи между ними. Межатомные связи должны также соответствовать пространственному расположению атомов. Этапы развития представлений о строении молекулы метана отражены на рис. 1. Современным данным отвечает структура г: молекула имеет форму правильного тетраэдра, в центре которого находится атом углерода, а в вершинах – атомы водорода.
 (6.58 Кб) (6.58 Кб)
Подобные исследования, однако, ничего не говорили о размерах молекул. Эта информация стала доступна лишь с разработкой соответствующих физических методов. Наиболее важным из них оказалась рентгеновская дифракция. Из картин рассеяния рентгеновских лучей на кристаллах появилась возможность определять точное положение атомов в кристалле, а для молекулярных кристаллов удалось локализовать атомы в отдельной молекуле. Среди других методов можно отметить дифракцию электронов при прохождении их через газы или пары и анализ вращательных спектров молекул.
Вся эта информация дает только общее представление о структуре молекулы. Природу химических связей позволяет исследовать современная квантовая теория. И хотя с достаточно высокой точностью молекулярную структуру рассчитать пока не удается, все известные данные о химических связях можно объяснить. Было даже предсказано существование новых типов химических связей.
Простая ковалентная связь.
Молекула водорода Н2 состоит из двух идентичных атомов. По данным физических измерений длина связи – расстояние между ядрами атомов водорода (протонами) – составляет 0,70 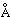 (1 (1 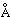 = 10–8 см), что отвечает радиусу атома водорода в основном состоянии, т.е. в состоянии с минимальной энергией. Образование связи между атомами можно объяснить лишь в предположении, что их электроны локализуются в основном между ядрами, образуя облако отрицательно заряженных связывающих частиц и удерживая вместе положительно заряженные протоны. = 10–8 см), что отвечает радиусу атома водорода в основном состоянии, т.е. в состоянии с минимальной энергией. Образование связи между атомами можно объяснить лишь в предположении, что их электроны локализуются в основном между ядрами, образуя облако отрицательно заряженных связывающих частиц и удерживая вместе положительно заряженные протоны.
Рассмотрим два водородных атома в основном состоянии, т.е. состоянии, в котором их электроны находятся на 1 s-орбитали. Каждый из этих электронов можно рассматривать как волну, а орбиталь – как стоячую волну. При сближении атомов орбитали начинают перекрываться (рис. 2), и, как в случае обычных волн, возникает интерференция – наложение волн (волновых функций) в области перекрывания. Если знаки волновых функций противоположны, то при интерференции волны уничтожают друг друга (деструктивная интерференция), а если одинаковы, то происходит их сложение (конструктивная интерференция). При сближении атомов водорода возможны два исхода в зависимости от того, находятся ли волновые функции в фазе (рис. 2,а) или в противофазе (рис. 2,б). В первом случае произойдет конструктивная интерференция, во втором – деструктивная, при этом появятся две молекулярные орбитали; для одной из них характерна высокая плотность в области между ядрами (рис. 2,в), для другой – низкая (рис. 2,г) – фактически узел с нулевой амплитудой, разделяющей ядра.
 (11.11 Кб) (11.11 Кб)
Таким образом, при сближении атомов водорода и их взаимодействии 1 s-орбитали образуют две молекулярные орбитали, а два электрона должны заполнить какую-то одну из них. Электроны в атомах всегда стремятся занять наиболее устойчивое положение – то, в котором их энергия минимальна. Для орбитали, показанной на рис. 2,в, характерна высокая плотность в области между ядрами, и каждый электрон, занявший эту орбиталь, будет б льшую часть времени находиться вблизи положительно заряженных ядер, т.е. его потенциальная энергия будет мала. Напротив, у орбитали, показанной на рис. 2,г, максимальная плотность имеет место в областях, расположенных слева и справа от ядер, и энергия электронов, находящихся на этой орбитали, будет велика. Итак, электроны обладают меньшей энергией, когда они занимают орбиталь в, причем эта энергия даже меньше той, которая была бы у них при бесконечном удалении атомов друг от друга. Поскольку в данном случае имеются только два электрона, оба они могут занимать более выгодную с энергетической точки зрения орбиталь, если их спины антипараллельны (принцип Паули). Поэтому энергия системы, состоящей из двух атомов водорода, при сближении атомов уменьшается, и чтобы затем удалить атомы друг от друга, потребуется энергия, равная энергии образования стабильной молекулы водорода Н2. Заметим, что необходимым условием существования молекулы водорода является преимущественная локализация электронов между ядрами в соответствии с тем, что мы уже говорили выше. Молекулярную орбиталь в называют связывающей, а орбиталь г – разрыхляющей. льшую часть времени находиться вблизи положительно заряженных ядер, т.е. его потенциальная энергия будет мала. Напротив, у орбитали, показанной на рис. 2,г, максимальная плотность имеет место в областях, расположенных слева и справа от ядер, и энергия электронов, находящихся на этой орбитали, будет велика. Итак, электроны обладают меньшей энергией, когда они занимают орбиталь в, причем эта энергия даже меньше той, которая была бы у них при бесконечном удалении атомов друг от друга. Поскольку в данном случае имеются только два электрона, оба они могут занимать более выгодную с энергетической точки зрения орбиталь, если их спины антипараллельны (принцип Паули). Поэтому энергия системы, состоящей из двух атомов водорода, при сближении атомов уменьшается, и чтобы затем удалить атомы друг от друга, потребуется энергия, равная энергии образования стабильной молекулы водорода Н2. Заметим, что необходимым условием существования молекулы водорода является преимущественная локализация электронов между ядрами в соответствии с тем, что мы уже говорили выше. Молекулярную орбиталь в называют связывающей, а орбиталь г – разрыхляющей.
Рассмотрим теперь сближение двух атомов гелия (атомный номер 2). Здесь тоже перекрывание 1 s-орбиталей приводит к образованию двух молекулярных орбиталей, одной из которых соответствует более низкая, а другой – более высокая энергия. На этот раз, однако, на орбиталях необходимо разместить 4 электрона, по 2 электрона от каждого атома гелия. Низкоэнергетическую связывающую орбиталь могут заполнить только два из них, два других должны занять высокоэнергетическую орбиталь г. Уменьшение энергии вследствие благоприятной локализации первой пары примерно равно увеличению энергии, обусловленному неблагоприятным расположением второй пары. Теперь сближение атомов не дает выигрыша в энергии, и молекулярный гелий Не2 не образуется. Это удобно проиллюстрировать с помощью диаграммы (рис. 3); разные орбитали на ней представлены в виде энергетических уровней, на которых могут находиться электроны. Последние обозначены стрелками, направленными вверх и вниз, чтобы различить направления спинов. Два электрона могут занимать одну орбиталь, только если их спины антипараллельны.
 (10.30 Кб) (10.30 Кб)
Эти общие принципы выполняются при образовании молекул из атомов. Как только два атома сближаются настолько, что их атомные орбитали (АО) начинают перекрываться, появляются две молекулярные орбитали (МО): одна связывающая, другая разрыхляющая. Если на каждой из АО находится только по одному электрону, оба они могут занять связывающую МО с меньшей энергией, чем у АО, и образовать химическую связь. Связи такого типа, называемые теперь ковалентными, были давно известны химикам (представления о ковалентной связи легли в основу октетной теории связи, сформулированной американским физикохимиком Г.Льюисом в 1916). Их образование объясняли обобществлением пары электронов взаимодействующими атомами. Согласно современным представлениям, прочность связи зависит от степени перекрывания соответствующих орбиталей. Все сказанное выше позволяет предположить, что связи между атомами могут образовываться при обобществлении не только двух, но также одного или трех электронов. Однако они будут слабее обычных ковалентных связей по следующим причинам. При образовании одноэлектронной связи происходит уменьшение энергии только одного электрона, а в случае образования связи в результате обобществления трех электронов у двух из них энергия уменьшается, а у третьего, наоборот, увеличивается, компенсируя уменьшение энергии одного из первых двух электронов. В результате образующаяся трехэлектронная связь оказывается вдвое слабее обычной ковалентной.
Обобществление одного и трех электронов происходит при образовании молекулярного иона водорода Н 2+ и молекулы ННе соответственно. Вообще же связи такого типа встречаются редко, а соответствующие молекулы обладают высокой реакционной способностью.
дальше
|
 |
 |



|


 (6.58 Кб)
(6.58 Кб)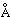 (1
(1  (11.11 Кб)
(11.11 Кб) льшую часть времени находиться вблизи положительно заряженных ядер, т.е. его потенциальная энергия будет мала. Напротив, у орбитали, показанной на рис. 2,г, максимальная плотность имеет место в областях, расположенных слева и справа от ядер, и энергия электронов, находящихся на этой орбитали, будет велика. Итак, электроны обладают меньшей энергией, когда они занимают орбиталь в, причем эта энергия даже меньше той, которая была бы у них при бесконечном удалении атомов друг от друга. Поскольку в данном случае имеются только два электрона, оба они могут занимать более выгодную с энергетической точки зрения орбиталь, если их спины антипараллельны (принцип Паули). Поэтому энергия системы, состоящей из двух атомов водорода, при сближении атомов уменьшается, и чтобы затем удалить атомы друг от друга, потребуется энергия, равная энергии образования стабильной молекулы водорода Н2. Заметим, что необходимым условием существования молекулы водорода является преимущественная локализация электронов между ядрами в соответствии с тем, что мы уже говорили выше. Молекулярную орбиталь в называют связывающей, а орбиталь г – разрыхляющей.
льшую часть времени находиться вблизи положительно заряженных ядер, т.е. его потенциальная энергия будет мала. Напротив, у орбитали, показанной на рис. 2,г, максимальная плотность имеет место в областях, расположенных слева и справа от ядер, и энергия электронов, находящихся на этой орбитали, будет велика. Итак, электроны обладают меньшей энергией, когда они занимают орбиталь в, причем эта энергия даже меньше той, которая была бы у них при бесконечном удалении атомов друг от друга. Поскольку в данном случае имеются только два электрона, оба они могут занимать более выгодную с энергетической точки зрения орбиталь, если их спины антипараллельны (принцип Паули). Поэтому энергия системы, состоящей из двух атомов водорода, при сближении атомов уменьшается, и чтобы затем удалить атомы друг от друга, потребуется энергия, равная энергии образования стабильной молекулы водорода Н2. Заметим, что необходимым условием существования молекулы водорода является преимущественная локализация электронов между ядрами в соответствии с тем, что мы уже говорили выше. Молекулярную орбиталь в называют связывающей, а орбиталь г – разрыхляющей.
 (10.30 Кб)
(10.30 Кб)